Почему замерзают аккумуляторы?
Превратить автомобилиста в пешехода в считанные минуты могут, пожалуй, три явления: внезапная поломка машины, ДТП и сильный мороз. Тема морозов, «умерших» аккумуляторов и утренних «упражнений» на стоянке жителям Тюмени близка, как никому.
Наверняка вы можете припомнить случай, когда морозным утром в понедельник спеша на работу, вы падали на сиденье любимого автомобиля, вставляли ключ в замок зажигания и вместо довольного урчания двигателя слышали слабое «барахтанье» стартера. Безнадёжно «севший» аккумулятор — проблема близкая всем автовладельцам, и особенно хозяевам старых автомобилей.
При эксплуатации автомобиля в жестких условиях сибирской зимы одной емкости маловато, нужны еще и увеличенные стартерные токи холодной прокрутки. Дело в том, что чем больше емкость и пусковые токи холодной прокрутки, тем при более высоком напряжении происходит запуск двигателя, падение напряжения при пуске минимально ( на шоферском сленге – просадка напряжения).

Что касается температур замерзания электролита, то температура замерзания электролита заряженного аккумулятора минус 70°С , такой аккумулятор не разморозится.
Иногда такие простые, казалось бы, причины, как ослабление или окисление контактов соединения с электропроводкой приводят к снижению эффективности зарядки от генератора из-за падения напряжения на клеммах аккумулятора, при этом сам аккумулятор абсолютно исправен, но систематически недозаряжается. Прибавьте к этому низкую температуру за бортом автомобиля, и получите результат — аккумулятор не принимает заряд.
Этому явлению есть довольно простое объяснение. При низких температурах в аккумуляторах повышается вязкость электролита, скорость протекания электрохимических реакций замедляется, и в итоге снижается способность аккумулятора быстро заряжаться.
В таких случаях автомобилисты вынуждены эксплуатировать свои аккумуляторы в состоянии неполного заряда и, естественно, с более низкой емкостью. При каждом последующем пуске аккумулятор, как правило, недопустимо глубоко разряжается, а зарядиться быстро и до требуемой емкости и напряжения уже не может.
Конечно, электролит замерзнуть не может, а вот когда весь ресурс аккумулятора исчерпан и вся серная кислота израсходована на процессы разрядки, то в электролите остается практически одна вода, температура замерзания которой составляет 0°С.
Ниже приведены температуры замерзания электролита в аккумуляторе при разряде :
|
Плотность электролита ,приведенная к температуре 25ºC, г/см³ |
Температура замерзания, минус ºC |
|
|
7 |
|
1,120 |
10 |
|
1,140 |
14 |
|
1,160 |
18 |
|
1,180 |
|
|
1,200 |
28 батарея , разряженная на 50 % |
|
1,210 |
34 |
|
1,240 |
50 батарея , разряженная на 25 % |
|
1,300 | 70 |
Вода при замерзании увеличивается в объеме и выдавливает активную массу из ячеек решетки, из-за чего ослабляется контакт между активной массой и токоведущей основой, увеличивается сопротивление, в результате мы имеем снижение по токоотдаче, пусковой мощности аккумулятора и сроку службы. Такой аккумулятор теряет свой ресурс и, как правило, преждевременно выходит из строя.
Такой аккумулятор теряет свой ресурс и, как правило, преждевременно выходит из строя.
Именно поэтому величина и запас емкости в аккумуляторе в холодное время года имеет очень большое значение для условий беспроблемной эксплуатации.
Чтобы решить вышеперечисленные проблемы, на Тюменском заводе по производству стартерных аккумуляторных батарей «АЛЬКОР» налажен серийный выпуск аккумуляторных батарей торговых марок ARCTIC BATBEAR, TYUMEN BATBEAR, ТЮМЕНСКИЙ МЕДВЕДЬ, ЯМАЛ.
Эти аккумуляторы разработаны специально для эксплуатации в регионах с холодным климатом. В производстве используется новейшее импортное оборудование, особо чистые материалы, электролиты и вода, которая по содержанию примесей соответствует дистиллированной. Очистка воды производится на итальянской установке обратного осмоса с использованием мембраны.
В числе преимуществ батарей — высокий ток приема заряда и способность быстро восстанавливать энергию разряда при эксплуатации в холодное время года. Высокие токи холодного пуска при минус 18 °C – токи холодной прокрутки, обеспечивают аккумуляторам более высокую мощность и надежность запуска холодного двигателя .
Высокие токи холодного пуска при минус 18 °C – токи холодной прокрутки, обеспечивают аккумуляторам более высокую мощность и надежность запуска холодного двигателя .
Эксплуатация авто аккумулятора зимой
Что сделать, чтобы подготовить батарею к холодному времени года и какая плотность электролита нормальна для зимы?
Ответ:
У заряженной на 100% АКБ, изначально рассчитанной на использование в условиях умеренного климатического пояса, плотность электролита при стандартных +25оC должна колебаться между 1.27 и 1.30 г/см3. Если температура будет выше, плотность снизится, если вокруг будет холоднее – повысится. Именно поэтому на крайнем Севере используют аккумуляторы с более плотным электролитом (1.32 г/см3), а в тропических странах с более низким (1.24 /см3).
Перед наступлением холодов важно убедиться в том, что аккумулятор заряжен – в этом случае вы избежите замерзания электролита и связанных с ним проблем при пуске двигателя. Учтите также, что зимой на работу батареи серьёзное влияние оказывают утечки в системе электрооборудования и слабое натяжение генераторного ремня.
Что делать, если при старте двигателя в холода батарея разрядилась до нуля?
Ответ:
Зарядите батарею при помощи небольшого тока – причём провести зарядку нужно от стационарного устройства и не позже, чем через 2-3 дня с момента наступления глубокой разрядки.
В чём причина замерзания электролита?
Ответ:
Когда аккумулятор разряжается, плотность электролита падает – и, соответственно, становится ниже количество содержащейся в его растворе серной кислоты. Образуется вода, которая и замерзает. Чем сильнее разряжен аккумулятор, тем раньше электролит способен замёрзнуть. К примеру, при 1.11 г/см3 замерзание наступает уже при -7 градусах Цельсия, а при 1.27 г/см3 (нормальная плотность при полном заряде) только при -58 градусах.
Можно ли реанимировать батарею, если замёрз электролит?
Ответ:
Всё зависит от тяжести конкретного случая. Как правило, если аккумулятор замёрз не на весь объём, а его корпус не был деформирован, восстановить АКБ можно. Для этого занесите батарею в комнату, оставьте её там до тех пор, пока весь лёд не растает (это должно происходить при комнатной температуре, без лишнего нагрева), и уже после этого ставьте батарею на зарядку. Но учтите, что токовые характеристики аккумулятора в любом случае упадут, а электроды будут повреждены.
Для этого занесите батарею в комнату, оставьте её там до тех пор, пока весь лёд не растает (это должно происходить при комнатной температуре, без лишнего нагрева), и уже после этого ставьте батарею на зарядку. Но учтите, что токовые характеристики аккумулятора в любом случае упадут, а электроды будут повреждены.
Если перед тем, как стартовать двигатель в холода, ненадолго включить фары, станет ли запуск легче?
Ответ:
Нет, это один из самых вредных мифов. Эффект разогрева электролита, на который надеются в рассматриваемом случае, будет ничтожным, а значит, мощность разряда не вырастет. Более того: батарея на этой процедуре теряет драгоценную ёмкость, и есть шанс, что оставшегося заряда на старт мотора не хватит.
Почему в холода советуют использовать аккумуляторы с высокими пусковыми токами?
Ответ:
У холодного пуска есть несколько характерных особенностей:
- 1. Стартеру понадобится больше времени на успешную прокрутку мотора;
- 2.
 Сопротивление холодного мотора зимой возрастает в 2.5-3 раза;
Сопротивление холодного мотора зимой возрастает в 2.5-3 раза; - 3. Батарее нужно будет отдать большее количество энергии и мощности;
- 4. Чем холоднее вокруг, тем выше внутреннее сопротивление АКБ.
Именно поэтому для того, чтобы двигатель стартовал надёжно, лучше использовать аккумулятор, имеющий при аналогичных габаритах более высокие токи холодной прокрутки.
На старт двигателя в холода влияет только аккумулятор?
Ответ:
Нет, влияние также оказывает состояние свечей, электрического оборудования, топливной системы и электропроводки машины. Также много зависит от качества топлива, от масла, и, конечно, от опыта водителя.
Из-за чего замёрзла батарея?
Ответ:
Если у Вас замёрзла только одна ячейка, причина, вероятно, во внутреннем дефекте аккумулятора. Из-за него в этой ячейке снизилась плотность электролита, и он замёрз.
Если замёрзло несколько ячеек, дело в том, что аккумулятор был разряжен.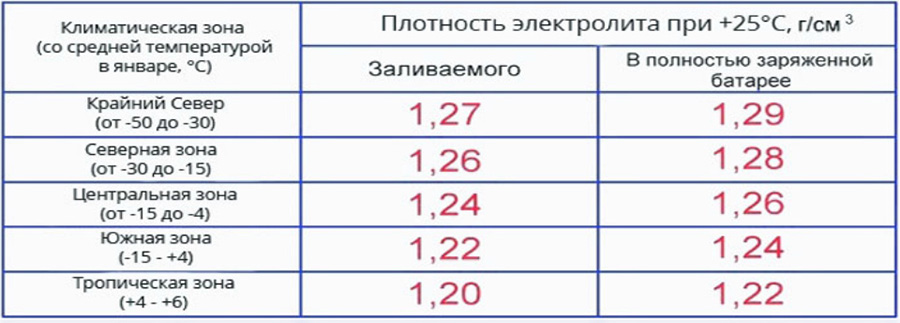 Чаще всего это происходит из-за того, что при поездках по городу приходится часто запускать мотор для передвижения на короткую дистанцию – генератору просто не хватает времени для того, чтобы зарядить батарею. Между тем, уже при 45% заряда аккумулятора плотность электролита будет составлять 1.21 г/см3, а при таких параметрах он замерзает уже при -30.
Чаще всего это происходит из-за того, что при поездках по городу приходится часто запускать мотор для передвижения на короткую дистанцию – генератору просто не хватает времени для того, чтобы зарядить батарею. Между тем, уже при 45% заряда аккумулятора плотность электролита будет составлять 1.21 г/см3, а при таких параметрах он замерзает уже при -30.
Часто бывает так, что утром не удаётся завести автомобиль, и водитель едет по своим делам на метро или автобусе. Тем временем, разряженная на попытках пуска батарея до вечера успеет замёрзнуть.
Эксплуатация свинцово-кислотных аккумуляторных батарей при отрицательных температурах
Условия эксплуатации свинцово-кислотных аккумуляторных батарей будь то в составе резервных источников питания, применяемых в системах автоматики и телемеханики на видах транспорта, телекоммуникационного оборудования и оборудования связи, охранных и пожарных систем безопасности и других устройств предусматривают различное их размещение и монтаж непосредственно на самих объектах эксплуатации.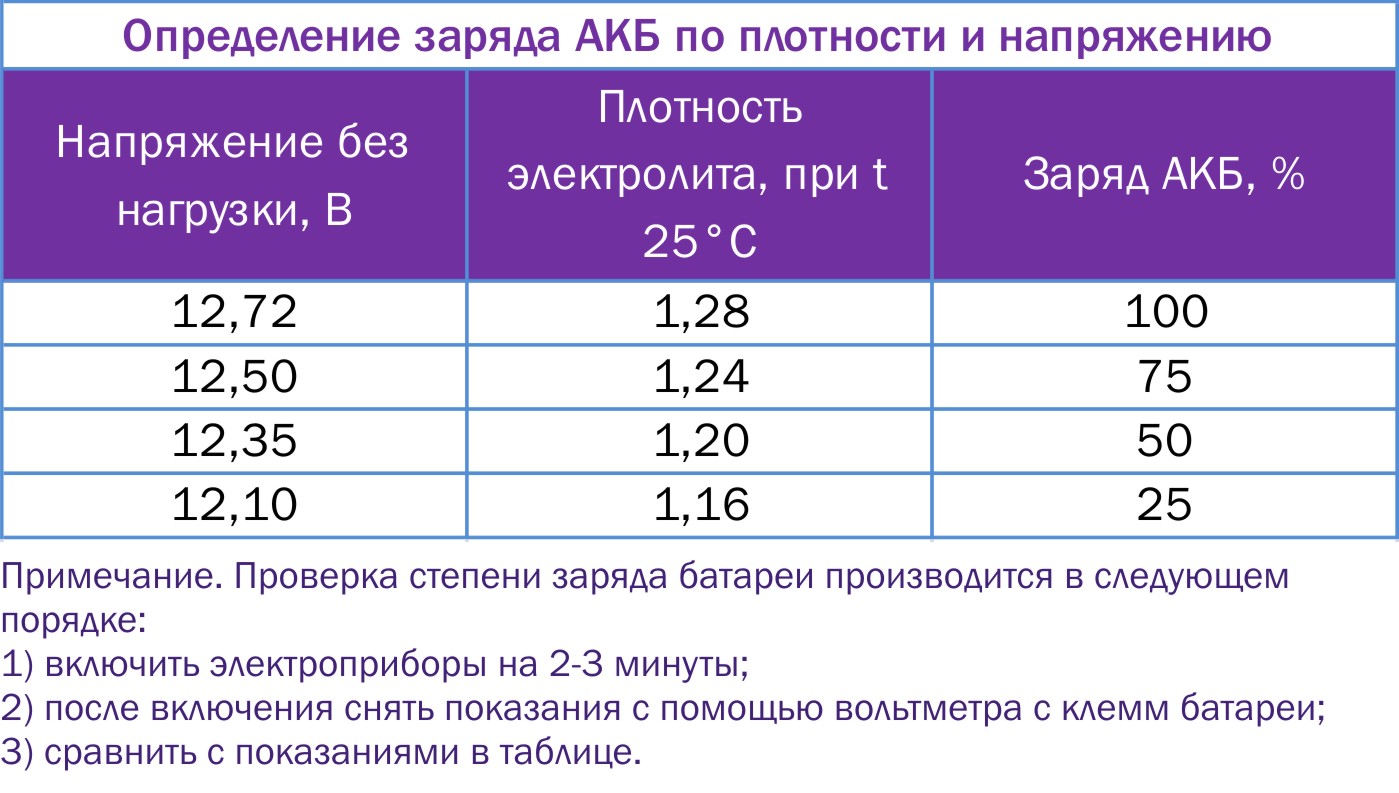
Все технические характеристики свинцово-кислотных аккумуляторов, включая проектируемый срок службы, определены для эталонной температуры 20° (как правило, для европейских производителей) или 25°С (преимущественно для производителей Юго-Востока Азии) в зависимости от серии батарей и производителей.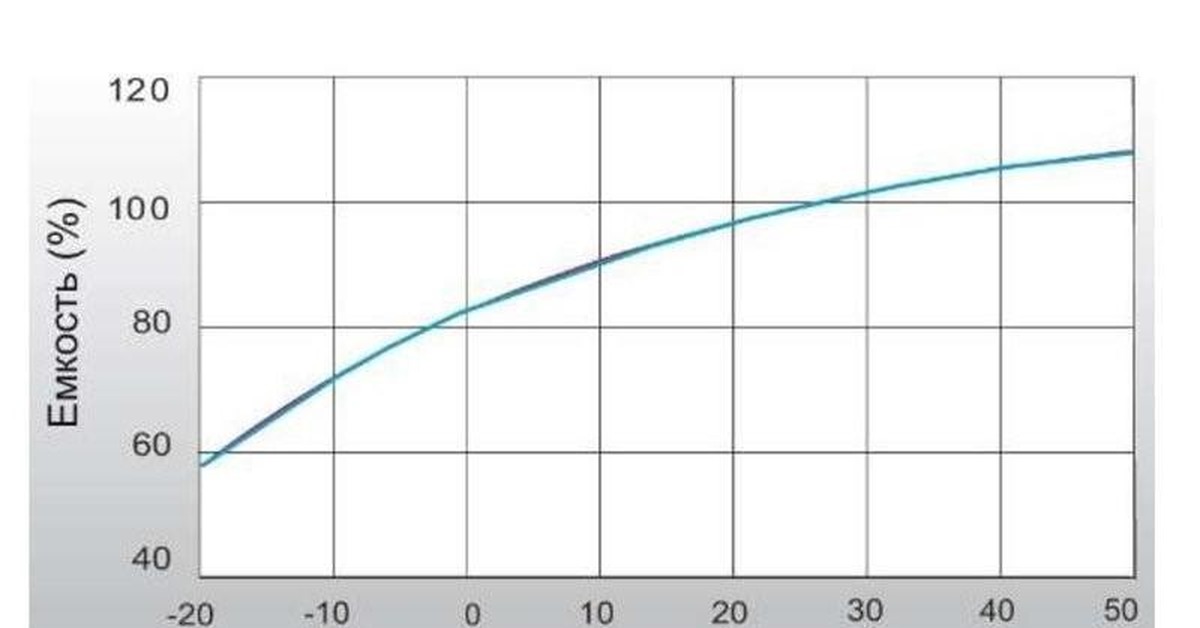 Поддерживать эту температуру в течение всего срока службы очень сложно, поэтому рекомендуемая температура эксплуатации без использования поправочного температурного коэффициента варьируется в пределах 10-30°С. Для многих типов аккумуляторов в этом диапазоне не требуется регулирование напряжения заряда с применением температурного коэффициента.
Поддерживать эту температуру в течение всего срока службы очень сложно, поэтому рекомендуемая температура эксплуатации без использования поправочного температурного коэффициента варьируется в пределах 10-30°С. Для многих типов аккумуляторов в этом диапазоне не требуется регулирование напряжения заряда с применением температурного коэффициента.
Зависимость емкости аккумулятора от температуры
Как уже отмечалось выше, условия работы батареи в наружных шкафах существенно отличаются от рекомендуемых производителем. В зимний период в зависимости от региона температура в них может опускаться ниже -50°С. Поэтому при этих условиях заряд аккумуляторных батарей, как правило, производят повышенным напряжением из расчета на 0,003 В/°С, отличной от рекомендованной заводом-изготовителем.
При эксплуатации свинцово-кислотных аккумуляторов при пониженной температуре ограничивается их допустимая разрядная емкость.Для свинцово-кислотных аккумуляторных батарей герметизированного исполнения («AGM» и «GEL») примерные данные зависимости емкости в процентном соотношении от температуры окружающей среды представлены в таблице.
Примерный график зависимости отдаваемой емкости (Сразр.) в процентном соотношении к номинальной емкости от температуры (°С) представлен на Рис. 1. Если исходить из того, что 100% емкость батареи соответствует температуре 25°С, то из графика видно, что с понижением температуры отличной от 25°С отдаваемая емкость аккумуляторных батарей падает, а с повышением, наоборот, возрастает.
Такое поведение свинцово-кислотного аккумулятора объясняется обратной зависимостью его внутреннего сопротивления от температуры. Величина сопротивления возрастает, прежде всего, за счет ухудшения проводимости электролита, а также по мере разряда аккумулятора. Это связано с тем, что при отрицательных температурах снижается скорость диффузии ионов электролита (и его концентрации в порах активной массы), проводимость самой активной массы и сепаратора. При этом уменьшается электропроводность в целом.С увеличением внутреннего сопротивления усиливается поляризация и создаются условия для образования мелкокристаллических плотных осадков сульфата свинца, вызывающих пассивирование отрицательного электрода.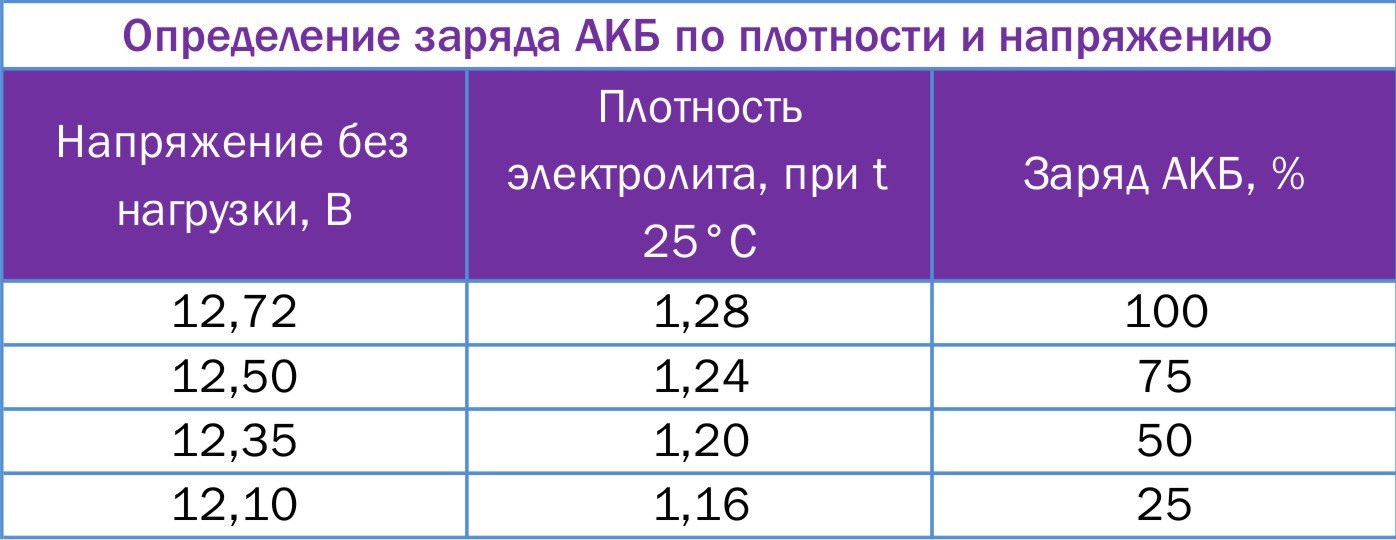
Если вспомнить Закон Ома для полной цепи (I= ε/R+r), который устанавливает связь между силой тока, электродвижущей силой (ЭДС) и внешним и внутренним сопротивлением в цепи, то видно, что чем выше внутреннее сопротивление (особенно электролита), а оно повышается с понижением температуры, тем меньше отдаваемый аккумуляторной батареей ток, а соответственно и емкость самой батареи.
Динамика снижения напряжения аккумулятора при разряде зависит от изменения ЭДС элемента, динамики роста его внутреннего сопротивления, а также величины тока разряда. Иными словами, чем ниже температура аккумулятора и больше ток разряда, тем быстрее упадет напряжение на его выводах и, соответственно, меньше окажется снятая емкость. Возникает эффект так называемой «кажущейся» потери емкости, когда запас непрореагировавших активных веществ еще достаточен, а разряд приходится прекращать из-за недопустимого снижения напряжения на выводах батареи.
Точка замерзания электролита
С понижением температуры увеличивается вязкость электролита, что затрудняет его проникновение в поры глубоких слоев активной массы пластин. При этом поверхностные слои активной массы быстрее преобразуются в PbS04 и кристаллы PbS04 закрывают поры активной массы, а поэтому химическая энергия, запасенная в глубоких слоях активной массы пластин, полностью не используется и разрядная емкость батареи понижается. При понижении температуры электролита ниже +25 °С емкость аккумуляторной батареи при ее разряде силой тока, соответствующей 0,05Сном., уменьшается на 1% на каждый градус понижения температуры, а при большей силе разрядного тока — на большую величину.
При этом поверхностные слои активной массы быстрее преобразуются в PbS04 и кристаллы PbS04 закрывают поры активной массы, а поэтому химическая энергия, запасенная в глубоких слоях активной массы пластин, полностью не используется и разрядная емкость батареи понижается. При понижении температуры электролита ниже +25 °С емкость аккумуляторной батареи при ее разряде силой тока, соответствующей 0,05Сном., уменьшается на 1% на каждый градус понижения температуры, а при большей силе разрядного тока — на большую величину.
Более того, работа аккумуляторной батареи при низких отрицательных температурах связана с опасностью замерзания электролита. Электролит свинцово-кислотного аккумулятора представляет собой водный раствор серной кислоты и непосредственно участвует в токообразующих реакциях. Из-за того, что при разряде расходуются молекулы серной кислоты и образуются молекулы воды, плотность электролита постепенно снижается.
Оценивая работоспособность аккумулятора при отрицательных температурах, необходимо учитывать не только номинальную (начальную) плотность его электролита, но и плотность в конце разряда при снятии расчетной емкости.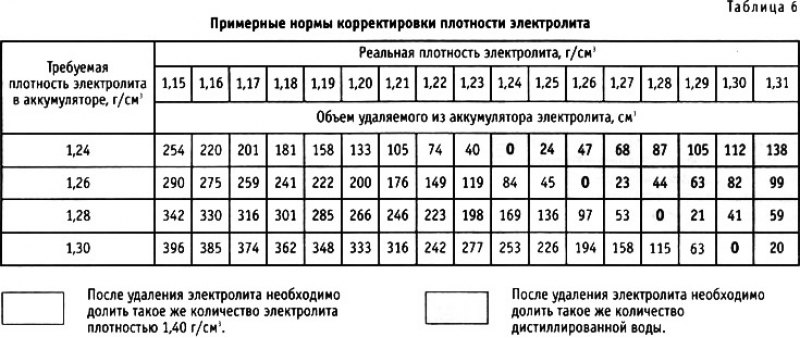
Начальная плотность электролита полностью заряженного аккумулятора зависит от его конструкции и технологии производства. Например, аккумуляторы со свободным электролитом в зависимости от модели могут иметь номинальную начальную плотность: 1,22; 1,24; 1,26 кг/л. Температуры замерзания электролита этих полностью заряженных батарей составляют: -32; -42 и -54°С, то есть аккумулятор с электролитом плотностью 1,24 кг/л нельзя разряжать при температуре ниже -40°С~-45°С из-за угрозы его замерзания. Поэтому эксплуатация батареи при температуре ниже точки замерзания электролита полностью заряженного аккумулятора недопустима.
Область замерзания электролита примерно одинакова для всех типов свинцово-кислотных аккумуляторных батарей. Усредненный график зависимости температуры замерзания электролита от плотности электролита представлен на рис. 2.
Кроме этого, в зависимости от температуры следует ограничивать глубину ее разряда. Чем ниже температура эксплуатации, тем меньше допустимая глубина разряда. Поэтому при отрицательной температуре приходится использовать аккумуляторы с повышенной номинальной емкостью.
Поэтому при отрицательной температуре приходится использовать аккумуляторы с повышенной номинальной емкостью.
Таким образом, если предполагается эксплуатировать свинцово-кислотные аккумуляторы при пониженной температуре, то при расчете и выборе батареи необходимо предусмотреть запас по емкости.
Ограничение отбора емкости батареи при отрицательной температуре — это принудительная остановка разряда или снятие с аккумуляторов определенного количества электричества. Более экономичное и технологичное решение — использование подогреваемых батарейных шкафов, особенно в регионах с холодным климатом. В идеальных условиях температура в них не должна опускаться ниже 5°С. Это предотвратило бы опасность замерзания электролита и ограничило коэффициент запаса номинальной емкости относительно разрядной. Но даже поддержание температуры в шкафу в пределах оптимальной существенно облегчит выбор батареи и сделает ее работу более предсказуемой.
Чем опасен сильный разряд аккумулятора при замерзании в авто — журнал За рулем
Как отмечают специалисты сервис-центров, нередко причинами плохого пуска окоченевшего на морозе мотора оказываются дефекты бортовой сети автомобиля и плохая работа аккумуляторной батареи (АКБ). На каких моментах следует акцентировать внимание, чтобы избежать подобных проблем?
Не секрет, что осенью и зимой у автомобилей чаще всего фиксируются проблемы, связанные с затрудненным пуском холодного двигателя. Наверняка многим водителям знакома такая ситуация: когда включаешь стартер, он «молчит», а вместо этого слышны какие-то щелчки. Приходится несколько раз подряд включать-выключать зажигание, чтобы «пускач» наконец начал прокручивать стартер.
Впрочем, приведенный выше пример — это, как говорится, только «цветочки»! Как правило, при наличии исправной системы зажигания и правильно заряженной батареи причина подобных неполадок выявляется легко. Обычно они вызваны ослаблением механических соединений силовых проводов, питающих стартер, а также коррозией контактирующих поверхностей.
Например, при перепадах температур нередко слабеет «хват» стальных наконечников у мощных кабелей, соединяемых со свинцовыми выводами батареи. А неплотное соединение — это, по сути, своеобразный изолятор, резко снижающий пусковой ток. Поэтому самый простой способ устранения дефекта — своевременное подтягивание всех резьбовых и винтовых контактов бортовой электросети. Особенно это важно проверять на проводах, идущих к аккумулятору.
Когда замерзает электролит
Гораздо хуже, если виновником затрудненного пуска холодного двигателя становится сам бортовой источник питания. На этом эксплуатационном аспекте следует заострить внимание. Начнем с того, что стартерный автомобильный аккумулятор — это электрохимический свинцово-кислотный источник тока. Поэтому его работоспособность и пусковые характеристики во многом зависят от таких показателей, как температура внешней среды, степень заряженности и плотность электролита, залитого в АКБ. Чтобы лучше понять их взаимосвязь, приведем в качестве примера исследования специалистов словенской компании TAB, выпускающей одноименные аккумуляторы TAB, а также популярные батареи Topla.
Итак, при правильной эксплуатации АКБ, когда она полностью заряжена, плотность электролита будет близка к значению 1,29 г/см3 и сохранять свою текучесть почти до —60о С. Это значит, что аккумулятор будет крутить стартер даже при —50о С. Это качество фирменных батарей TAB и Topla уже по достоинству оценили многие российские автовладельцы, в том числе и те, кто проживает на Севере. Когда же уровень заряда аккумулятора понижается наполовину (до 50%), плотность его электролита падает до 1,19 г/см3. В этом случае он, конечно, тоже будет кратковременно работать, но только при температурах не ниже —24о С, при которой электролит попросту замерзнет.
Контроль за уровнем заряда АКБ
Следует понимать: приведенные как пример значения параметров АКБ обозначены как предельные. Очевидно, нарушать эти границы совсем нежелательно. Однако, часто из-за отсутствия опыта, некоторые автомобилисты этот факт игнорируют. Между тем в зимний период, особенно когда машина ночует на улице в сильные морозы, крайне важно контролировать уровень заряда аккумулятора и, если АКБ обслуживаемая, еще и плотность электролита.
Помните: электролит с плотностью менее 1,18 г/см3, находящийся в разряженном АКБ, может замерзнуть даже при относительно слабых (до —20о С) холодах. Причем при замерзании электролит превращается в лед. Расширяясь на морозе, он способен повредить как пластины батареи, так и ее корпус, который в подобных случаях нередко разбухает или трескается. В итоге аккумулятор выходит из строя, после чего его приходится попросту менять.
Пусковая энергетика
Отдельный вопрос — энергетические характеристики стартерного аккумулятора. В наших предыдущих статьях уже вкратце сообщалось о таких параметрах, как емкость (С20) и ток холодной прокрутки (ССА). Рекомендуемые значения данных параметров обычно указываются в инструкции к автомобилю. Очевидно, что они тоже зависят от температуры внешней среды. При ее понижении емкость АКБ и выдаваемый пусковой ток тоже уменьшаются, причем характер этой зависимости оказывается нелинейным.
Кстати, не все водители знают, что нормативный ток холодной прокрутки ССА) измеряется при —18о С. При этом, согласно методике ЕN, напряжение на клеммах АКБ во время испытания не должно опускаться ниже 6,2 В. На этот момент стоит обратить особое внимание. По мнению специалистов компании TAB, в машинах, которые зимой часто эксплуатируются при температурах ниже —18о С, предпочтительнее использовать аккумуляторы с максимально возможным пусковым током (фото выше). Это позволит избежать проблем с запуском двигателя при сильных холодах.
Запас емкости лишним не будет
Данная рекомендация обусловлена спецификой работы бортовых компьютеров в ряде современных автомобилей. Их «электронные мозги» прерывают процедуру запуска двигателя, когда напряжение бортсети в начальной фазе (первые 10–20 мс работы стартера) падает ниже заданного предела 5,5 В. Поэтому, чтобы напряжение не «проседало» до критического уровня при запуске застывшего на морозе двигателя, рекомендуется взять АКБ с более высокой, чем у штатной батареи, энергоемкостью.
В качестве примера рассмотрим случай, когда в машине штатно используется аккумулятор европейского типа с емкостью 60 Ач и пусковым током до 600 А. Найти АКБ с такими параметрами труда не составит. Однако, следуя рекомендациям специалистов TAB, в канун зимы лучше установить более мощную батарею того же типоразмера. Например, популярный аккумулятор Topla Energy с емкостью 66 Ач и током 620 А (фото выше). У него более чем 10-процентное превышение производительности в сравнении со штатным АКБ. А такой запас энергоресурса гарантированно повысит шансы для надежного запуска холодного двигателя в зимний период.
Что нельзя делать с аккумулятором летом, чтобы он не «умер» зимой
Когда ваш автомобильный аккумулятор подводит и машина не заводится, это крайне неприятно. Между тем нередко виноват сам водитель, не выполнявший ряд простых правил. Разберемся, какие именно ошибки могут сократить жизнь АКБ даже летом.
Как можно убить аккумулятор быстрее всего
Самый простой путь вывести из строя аккумулятор — это долить в электролит обычную воду — электроды в таком случае выйдут из строя.
Жизнь АКБ может радикально сократить также заряд током чрезмерно большой силы, перегрев электролита и его повышенная плотность, повышенное и пониженное напряжение в бортовой сети автомобиля, загрязнение электролита и короткое замыкание (возможно при неосторожном обращении с инструментом вблизи контактов батареи, или при повреждения изоляции силового кабеля). Однако существуют и менее явные огрехи, которые также вредны для АКБ. Читайте о них ниже.
Не поддерживать чистоту
При эксплуатации автомобиля в особенности в условиях повышенной загрязненности (пыль, песок, пыльца деревьев и т.п.) следует уделять особое внимание чистоте корпуса АКБ. Ведь если грязь просочится в электролит, печальная судьба батареи по сути предрешена.
Загрязнения на корпусе следует регулярно устранять мягкой тряпкой, смоченной в растворе нашатырного спирта или кальцинированной соды.
Используйте зубную щетку или мелкую шкурку, чтобы удалить любые следы коррозии, если вы обнаружите их на клеммах аккумулятора. Лишняя грязь и следы окисления на клеммах провоцируют замыкание и разрядку АКБ. Не забывайте также проверять надежность крепления как самого аккумулятора, так и его клемм.
Игнорировать температурный режим
Не секрет, что аккумуляторы постепенно подсаживаются от скачков температуры в межсезонье и долгого отсутствия нагрузки. При падении плотности электролит замерзает — это вызывая деформации и осыпание пластин, равно как прожоги от коротких замыканий. Поэтому не следует оставлять ваш автомобиль на недели и месяцы на улице в мороз.
Регулярно заводите ваш автомобиль зимой, а еще лучше — совершайте хотя бы короткие поездки, чтобы батарея могла подзарядиться. Гаражное хранение — идеальный вариант, но даже в этом случае следует замерять тестером уровень заряда АКБ на заглушенном двигателе хотя бы раз в месяц. При полном заряде показания стремятся к значению 12.7 вольт. При почти полной разрядке будет примерно 12 вольт. При нормальной плотности электролита, которая должно составлять 1,27 г/см куб., образование льда начнется только при температуре ниже -65 град.
Перегружать батарею
Прежде всего, не перегружайте сеть. Различные усилители, доп.оборудование и девайсы типа видеорегистратора, радар-детектора и просто несколько подключенных к «мультимедийке» гаджетов — это, конечно, замечательно. Но такая прорва потребителей неизбежно повысит нагрузку на сеть.
Нередки также случаи запредельных разрядов, например, после пуска двигателя стартером. Или, скажем, если вы регулярно даете «прикурить» друзьям и соседям (особенно если потенциал их АКБ больше, чем у вашего), это также не идет на пользу батарее. Кроме того, помогая такому аккумулятору, который уже «дышит на ладан», донор может еще и спалить бортовую электронику.
Неправильное обслуживание
Если ваш аккумулятор обслуживаемый, то в рамках самостоятельного «ТО» следует долить нужное количество смести дистиллированной воды и электролита (у автомобильных аккумуляторов принято считать нормальным уровень заливки на 10-15 мм выше верхней кромки пластин) и убедиться в том что раствор имеют оптимальную плотность (1.27 г/см3).
Если в АКБ пониженная плотность смеси, то это может привести к быстрому разряду и замерзанию раствора. Если плотность повышенная — тоже плохо: чревато «обезвоживанием», и, как следствие, разъеданием пластин. Плотность состава измеряется специальным прибором — ареометром (денсиметром).
Совет «подснежникам» — отнесите аккумулятор домой зимой
Есть категория водителей, которые по тем или иным причинам не ездят зимой. Для таких людей имеет прямой смысл позаботится об аккумуляторе. АКБ необходимо снять и отнести домой или в теплый гараж. Хранить батарею рекомендуется при комнатной температуре. При этом каждые два — три месяца аккумулятор рекомендуется подзаряжать, предварительно проверяя уровень зарядки с помощью вольтметра.
Плотность электролита в аккумуляторе — какая должна быть
Автомобильный аккумулятор предназначен для обеспечения бортовой сети транспортного средства и накопления энергии, которую вырабатывает генератор. Больше века кислотно-свинцовые батареи применяются в автомобильной промышленности и по-прежнему удерживают лидирующие позиции. Причина долголетия проста – высокая эффективность при дешевой себестоимости. Подобные батареи состоят из гальванических элементов, которые взаимодействуя с водным раствором серной кислоты, вырабатывают электрическую энергию. Такие источники питания имеют стабильную плотность электролита в аккумуляторе, отличаются высокой морозоустойчивостью и длительным сроком работы.
Плотность электролита
Электролит — это основной компонент аккумулятора, а именно, вещество, проводящее электрический ток вследствие распада на ионы в растворе. Основным свойством, которое необходимо знать при использовании АКБ в автомобиле, является плотность электролита — в науке данный термин означает соотношение массы жидкости к занимаемому объему. В АКБ роль раствора выполняет электролит, состоящий из кислоты и дистиллированный воды.
Непосредственно плотность зависит от температуры электролита (чем ниже температура, тем выше плотность). Работа аккумулятора – это чередование циклов разрядки и зарядки, во время которых происходит широкий спектр химических реакций. При разрядке батареи химическая энергия трансформируется в электрический ток, при зарядке электричество превращается в химическую энергию. Данные процессы оказывают серьезное влияние на плотность электролитического раствора. Процесс зарядки повышает плотность электролита, разряд элемента питания – понижает это значение.
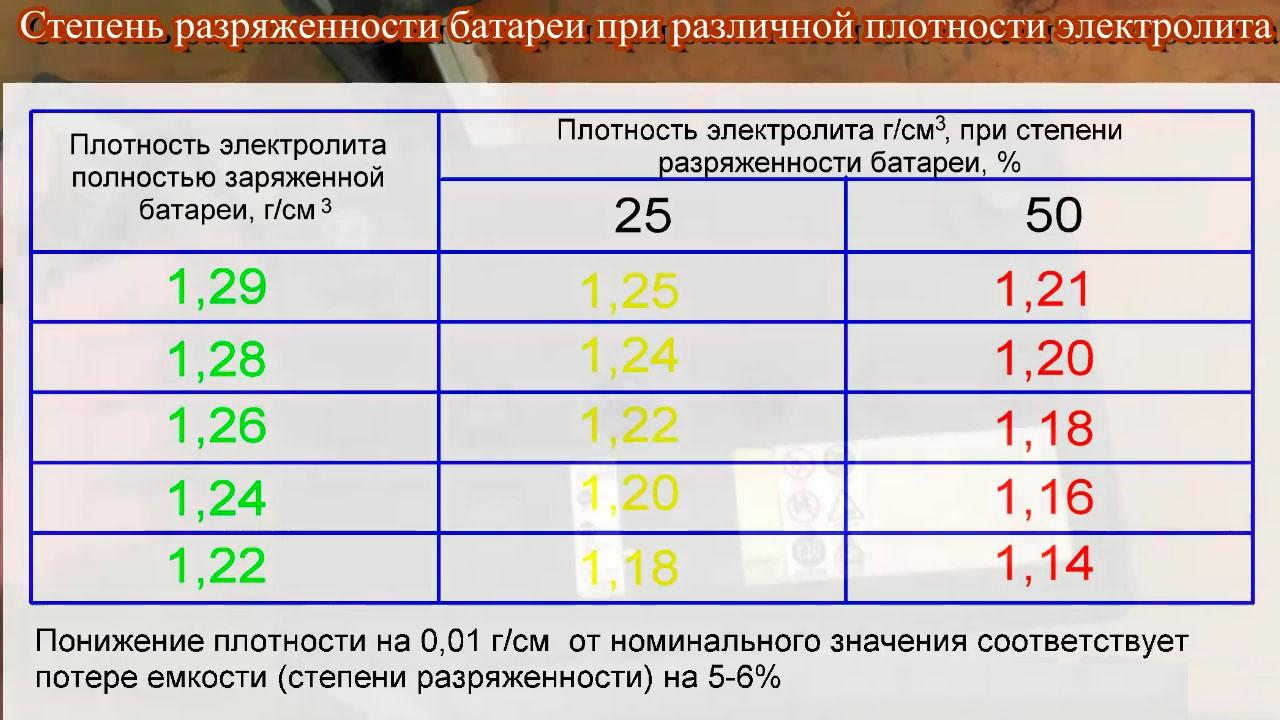
Температура замерзания электролита в зависимости от плотности — Таблица 1
С помощью прибора ареометра можно замерить плотность электролита в аккумуляторе, а также точно определить степень зарядки АКБ. При полном разряде батареи, показатель плотности падает настолько, что между пластинами остается практически дистиллированная вода. Сульфат свинца, который избыточно вырабатывается во время разряда, полноценно не расходуется при зарядке батареи и покрывает свинцовые пластины белым налетом. Сульфатация негативно влияет на емкость аккумулятора, сокращая рабочий ресурс источника питания. Свинцовые пластины со временем начинают осыпаться, что приводит к короткому замыканию внутри батареи.
Поскольку электролит является смесью воды и кислоты, то плотность электролита в аккумуляторе может возрастать. При зарядке АКБ происходит электролиз – выкипание дистиллированной воды из корпуса, благодаря чему концентрация кислоты в растворе возрастает, увеличивая его плотность. Печальная перспектива электролиза очевидна. Потеря воды неизбежно приведет к уменьшению уровня жидкости. Свинцовые пластины оголятся и вступят в химическую реакцию с кислородом, что приведет к осыпанию свинца и выходу батареи из строя. Именно поэтому важно остановить зарядку батареи при первых признаках кипения жидкости и своевременно доливать дистиллят при низком уровне электролита в обслуживаемых батареях.
Какая должна быть плотность электролита в аккумуляторе
Отечественные автовладельцы ведут отчаянный спор о правилах эксплуатации аккумуляторных батарей. Количество автомобилей стремительно растет, и каждый водитель пытается сформулировать свою позицию по данному вопросу. Даже среди профильных специалистов мнения существенно разнятся. Поэтому будем отталкиваться от рекомендаций производителей, ведь только разработчики элементов питания способны сформулировать нюансы эксплуатации собственных изделий. Любая новая АКБ имеет сопроводительную инструкцию, в которой конкретно прописаны мероприятия по техническому обслуживанию.
Аккумуляторная батарея негативно воспринимает и повышенную, и пониженную плотность электролита. Высокий показатель плотности активизирует химические процессы, делая электролит «агрессивным», что приводит к значительному снижению рабочего ресурса изделия. Низкая плотность уменьшит емкость АКБ, что способствует проблемам запуска силового агрегата, особенно в зимнее время. Именно по этой причине необходимо придерживаться значений, рекомендованных производителем. Плотность полностью заряженного нового аккумулятора должна составлять 1.27 г/см3 при температуре +25 °С. При жарком климате допускается понижение плотности на 0,01 г/см3 , а при морозах — на 0,01 — 0,02 г/см3 больше.
Плотность электролита в аккумуляторе зимой и летом
Современный аккумулятор – устройство, сбалансированное и беспричинно корректировать электролит бессмысленно. Плотность электролита в аккумуляторе 1.27 г/см3 не позволит кристаллизоваться жидкости до –50°С. Подобные экстремальные температуры встречаются только на крайнем севере. В таких регионах плотность увеличивают, чтобы предотвратить замерзание электролита. Лучше своевременно заряжать батарею и не допускать разряда, чтобы показатель плотности держался в номинальном значении. Поскольку температура окружающей среды изменчива, то для замера плотности электролита предлагаем использовать специальную таблицу с поправками.
Плотность электролита в аккумуляторе зимой и летом — Таблица 2
Как проверить плотность электролита в аккумуляторе
Данную процедуру необходимо выполнять с периодичностью в три месяца или каждые 15-20 тыс. км, дабы контролировать работоспособность элемента питания. Также замеры производят при покупке новой батареи или при возникновении проблем во время запуска двигателя. Проверку можно выполнить на станции технического обслуживания или самостоятельно в условиях гаража. Перед проверкой показателя электролита следует полностью зарядить аккумулятор и сделать временную паузу длительностью шесть часов. Ведь во время зарядки плотность электролита повышается и информация будет некорректной. Для процедуры измерения потребуется ареометр, который можно приобрести в любом автомагазине. Данное устройство вполне доступно, так как имеет низкую цену.
Для работы потребуется:
- Ареометр
- Защитные очки
- Сухая хлопчатобумажная ткань
- Резиновые перчатки.
Перед измерением источник питания необходимо установить на ровную поверхность и выкрутить заглушки. Далее следует рукой сжать резиновую грушу прибора и опустить наконечник ареометра в крайнюю банку АКБ. Погрузив устройство в электролит, грушу можно отпустить. Разряженный воздух в колбе, начнёт засасывать жидкость из банки. Теперь нужно визуально оценить уровень раствора в ареометре. Количество жидкости должно позволить измерительному поплавку свободно плавать внутри прибора.
После того, как поплавок прекратит колебательные движения, можно зафиксировать показатель плотности электролита, который должен составлять 1,24 – 1,29 г/см3. Если цифры существенно отличаются, то следует выполнить коррекцию плотности раствора. Аналогичные процедуры необходимо произвести со всеми банками аккумулятора. Следует помнить, что любые операции с электролитом необходимо выполнять в защитных перчатках и очках. После завершения работ пластиковый корпус АКБ рекомендуется насухо протереть чистой тряпкой, дыбы исключить саморазряд батареи.
Коррекция плотности электролита
Эксплуатация автомобиля подразумевает циклическую нагрузку на АКБ, во время которой катализатор электрохимического процесса изменяет свою структуру. Поскольку электролит состоит из кислоты(35%) и дистиллированной воды(65%), то это соотношение способно изменяться в зависимости от степени заряженности источника энергии. Во время движения транспортного средства генератор постоянно подает на батарею электрический ток.
Когда емкость восстанавливается, начинается процесс электролиза, во время которого электролит закипает и испаряется. Аналогичный процесс происходит при длительной зарядке специальным устройством. Количество воды в растворе уменьшается, из-за чего увеличивается плотность и убавляется объем жидкости. Чтобы восстановить номинальное значение необходимо долить дистиллированную воду в каждую банку батареи.
Причины снижения плотности электролита
Чтобы поддержать работоспособность элемента питания автовладельцы добавляют в батарею дистиллированную воду, забывая проверить показатели плотности. Большая концентрация воды приводит к сильному электролизу, во время которого вместе с водой начинает испаряться серная кислота, что снижает плотность электролита. Со временем содержание кислоты в растворе становится критическим и раствор перестает выполнять функцию катализатора химических процессов, что негативно отражается на функциональности аккумулятора.
Как повысить плотность электролита в аккумуляторе в домашних условиях
Любая батарея состоит из нескольких банок, поэтому, чтобы поднять плотность электролита в аккумуляторе, придется корректировать электролитический раствор в каждой отдельной емкости. С помощью спринцовки жидкость выкачивается и отправляется в мерную емкость. После чего в банку заливается аналогичное количество нового электролита, который в готовом виде можно приобрести в магазине. Данная операция выполняется с каждой банкой, после чего аккумулятор необходимо зарядить в течение 30 минут, чтобы раствор перемешался. Затем после двухчасовой паузы повторно измеряем показатели плотности. При необходимости нужно повторить коррекцию электролита. Важно помнить, что разность плотности в банках не должна превышать 0.01 г/см3.
Бывают ситуации, когда показатель плотности падает ниже значения 1.18 г/см3. В таких случаях вышеописанная технология не поможет восстановить работоспособность батареи – необходима полная замена электролитического раствора.
Как поднять плотность электролита зарядным устройством
Существует еще один способ, которым следует поделиться. Он требует меньших трудозатрат и больше времени. Суть процесса проста – необходимо поставить батарею на зарядку, выставив минимальный ток (не более 1A). Достигнув полного заряда, аккумуляторная батарея начнет «кипеть». При этом дистиллированная вода будет активно испаряться. Уровень жидкости в корпусе постепенно снизится. Вместо испарившейся воды, доливаем электролит номинальной плотности. Процесс очень длительный, однако, за несколько суток можно добиться необходимого результата.
Как заменить электролит в аккумуляторе
С помощью замены электролита в аккумуляторе владелец автомобиля может значительно продлить рабочий ресурс АКБ. Замена потребует наличие следующих компонентов:
- Стеклянная линейка с узкой горловиной
- Емкость с дистиллятом
- Электролит необходимой плотности
- Зарядное устройство
- Ареометр
- Пищевая сода
- Средства защиты: (перчатки, фартук, очки)
- Резиновая груша
- Чистая ветошь.
Снятый с машины аккумулятор, тщательно протираем чистой ветошью, удаляя с поверхности грязь и пыль. Рекомендуется производить замену при комнатной температуре. После демонтажа крышек с банок производится откачка раствора. Переворачивать АКБ категорически запрещено, ведь химический осадок, скопившийся на дне, способен вызвать короткое замыкание в пластинах, после чего батарея придёт в негодность. Для удаления остатков электролита необходимо на дне каждой банки просверлить небольшое отверстие, через которое вытекут остатки жидкости.
Теперь в пустые банки заливается дистиллят, чтобы тщательно промыть внутренности батареи. Далее необходимо запаять отверстия специальным пластиком стойким к воздействию кислот. С помощью стеклянной воронки заливаем до необходимого уровня новый электролит, после чего аккумулятор ставится на зарядку. Для восстановления оптимальной емкости источник питания следует разрядить и снова зарядить. Заряженная полностью батарея должна выдавать напряжение 12.7 В. Процесс замены окончен, аккумулятор можно устанавливать на автомобиль.
Использованный электролит необходимо правильно утилизировать. Для этой цели потребуется сода, которая является щелочью и способна нейтрализовать разрушительное действие серной кислоты. В емкость с раствором высыпаем половину пачки соды и наблюдаем бурную химическую реакцию. После окончания бурления получившуюся субстанцию можно вылить в канализацию.
И напоследок совет: своевременно проверяйте плотность электролита своего аккумулятора и регулярно заряжайте батарею. Тогда источник питания «отблагодарит» своего хозяина длительной и бесперебойной работой.
Подготовка аккумулятора к зиме —
Подготовка к
Всем привет. Вот и наступила «долгожданная» зима, температура за бортом с каждым днем все ниже и ниже. А Вы подготовили свой аккумулятор к эксплуатации в зимний период? Что необходимо сделать для подготовки АКБ к зиме? Перво наперво необходимо проверить плотность электролита в батареи, ведь от плотности кислоты в аккумуляторе зависит его температура замерзания. Если плотность низкая, то жидкость в нем может замерзнуть и при малых морозах.
Температура замерзания электролита в зависимости от плотности
Итак, исходя из температуры замерзания, выбираем ту плотность, которая необходима Вам, для того, чтобы кислота не замерзла в аккумуляторе зимой — даже в лютые морозы. Я для себя выбрал плотность в 1,25 г/см3, так как наша суровая сибирская зима, градусов 40 стабильно выдает, но бывает что и больше, но редко. Так же зная свой климат, выбирайте плотность для своего АКБ.
Теперь необходимо привести плотность электролита к выбранной цели. Если плотность электролита маленькая, то необходимо ее поднять электролитом с плотностью 1,42 г/см3, как это сделать я подробно описывал в этой статье. Если плотность высокая, то ее нужно понизить, для этого пользуемся всеми приемами, что и при повышении плотности, только вместо электролита 1,42 используем дистиллированную воду, чтобы разбавить кислоту.
При повышении или понижении плотности жидкости наливаем меньше максимального уровня, чтобы в последствии можно было подкорректировать плотность доливкой необходимой жидкости. После того, как вы достигли необходимой плотности, необходимо проехать на своем авто порядка 200 км и вновь замерить плотность и при необходимости подправить плотность до нужной цифры и при этом долить жидкости в аккумулятор до нормы.
Норму кислоты в аккумуляторе проверяем следующим образом: отрезаем 6 полосок из плотного картона шириной 1 см и длиной 10-15 см. Такую полоску опускаем в первую банку АКБ, до упора в пластины и вынимаем. Смотрим на сколько промок картон — норма электролита выше на 10-15 мм от пластин, таким образом картон должен промокнуть на столько же. Соответственно если меньше, доливаем, если больше, откачиваем лишние. Такую операцию проводим с остальными банками.
И Заключительная действие — это помыть батарею от грязи. Через грязь идет медленная разрядка и если автомобиль долго не заводится, то это может привести к частичной разрядке батареи, что в зимнее крайне недопустимо, так как можно и не завестись при морозе.
Все эти несложные манипуляции с аккумулятором не только помогут Вам при эксплуатации его зимой, а также благоприятно повлияют на срок службы АКБ.
Меры по предотвращению замерзания электролита в аккумуляторных батареях -Shenzhen Power Kingdom Co., Ltd.-Power Kingdom
автор: : Power Kingdom 2020-02-28
В зависимости от степени разряда батареи, относительной плотности, точки замерзания в холодной области ( Ниже — 30 ℃) Если аккумулятор не чрезмерный разряд ( Зимой не более 25%) Или серная кислота в электролите без особых потерь, электролит не замерзнет.1, профилактические меры используются правильно и своевременно обслуживают аккумулятор, позволяют сохранить аккумулятор в хорошем техническом состоянии, продлить срок его службы и в то же время обеспечить надежность работы. Чтобы предотвратить попадание электролита в ледяную холодную область, ежедневное техническое обслуживание может принимать следующие меры: ( 1) Регулярно определять относительную плотность электролита, при обнаружении того, что не соответствует требованиям местного климата, своевременно корректировать.( 2) Сделайте аккумулятор полностью заряженным. Если одно из следующих явлений, необходимо пополнить заряд: (1) жидкий электролит Qian ниже плотности до 1. 20 ниже. Разряд более 25%, (2) разряд зимой летом превышает 50% (3) свет тусклый, чем обычно, говорит о нехватке электроэнергии. (4) запуск двигателя (когда он не мог Это не механическая поломка) ( 3) Если уровень жидкости электролита слишком низкий, необходимо добавить дистиллированную воду, можно только добавить дистиллированную воду перед зарядкой и сделать смешанную воду и электролит, как можно скорее, чтобы уменьшить вероятность того, что электролит ледяной.( 4) Не допускается использование общепромышленной серной кислоты и дистиллированной воды, поскольку она содержит примеси, вызовет разряд аккумулятора, снизит электрическую емкость аккумулятора, приведет к коррозии пластин, сократит срок службы пластины. Кроме того, если плотность электролита слишком мала, в холодном регионе также легко замерзнуть. ( 5) При температуре ниже — 30 ℃, чтобы предотвратить обледенение электролита, извлеките аккумулятор можно поместить в помещении 2, аккумулятор для хранения льда, электролит загрузчика, выбор аккумулятора, электрический, легко по сравнению с обычно большим, заводской аккумулятор, плотность электролита относительно велика, цель состоит в том, чтобы предотвратить электролит замерзает в холодной области, в то же время, также можно предотвратить, когда сернокислый электролит после небольшой потери, из-за влияния плотности электролита на емкость аккумулятора слишком мала.Таким образом, основной причиной обледенения электролита аккумуляторной батареи погрузчика является: ( 1) В процессе использования батареи потеря сернокислотного электролита слишком велика, если только добавить дистиллированную воду, это может привести к тому, что относительная плотность электролита не будет соответствовать требованиям местного климата, что приведет к замерзанию электролита. ( 2) Теоретически плотность электролита должна соответствовать требованиям местного климата. Но если из-за чрезмерной разрядки аккумулятора, может снизиться из-за плотности электролита, более высокой точки замерзания и замерзания.( 3) При добавлении дистиллированной воды дистиллированная вода не может смешаться с электролитом, электролит из-за местной температуры слишком низкий, и поэтому его легко заморозить.
Диапазон рабочих температур: Техническая поддержка
Емкость аккумулятора и время перезарядки аккумулятора основаны на каждой ячейке, имеющей температуру электролита 25 ° C (77 ° F). Температура ниже номинальной 25ºC (77ºF) снижает эффективную емкость аккумулятора и увеличивает время восстановления полной зарядки аккумулятора.Температура выше 25ºC (77ºF) немного увеличит емкость, но также увеличит саморазряд и сократит срок службы батареи.
Основные проблемы возникают при экстремальных температурах. Это диапазон от 4ºC (40ºF) до 38ºC (100ºF). Электролит в полностью заряженной батарее имеет точку замерзания около -65ºC (-85ºF), но электролит в полностью разряженной батарее с низким удельным весом имеет гораздо более высокую точку замерзания, чуть ниже 0ºC (32ºF). Полностью разряженный аккумулятор может замерзнуть ниже 4ºC (40ºF), и его следует немедленно зарядить, иначе это может привести к неисправимым повреждениям.
Более низкая температура — меньшая мощность, более интенсивная цикличность.
Более высокая температура — большая емкость, больший саморазряд и износ аккумулятора.
Эффект of Temperature
Емкость аккумулятора и время перезарядки аккумулятора основаны на каждой ячейке, имеющей температуру электролита 25 ° C (77 ° F). Температура ниже номинальной 25ºC (77ºF) снижает эффективную емкость аккумулятора и увеличивает время восстановления полной зарядки аккумулятора.Температура выше 25ºC (77ºF) немного увеличит емкость, но также увеличит саморазряд и сократит срок службы батареи.
Основные проблемы возникают при экстремальных температурах. Это диапазон от 4ºC (40ºF) до 38ºC (100ºF). Электролит в полностью заряженной батарее имеет точку замерзания около -65ºC (-85ºF), но электролит в полностью разряженной батарее с низким удельным весом имеет гораздо более высокую точку замерзания, чуть ниже 0ºC (32ºF). Полностью разряженный аккумулятор может замерзнуть при температуре ниже 4ºC (40ºF), и его следует немедленно зарядить, иначе это может привести к неисправимым повреждениям.
Более низкая температура — меньшая мощность, более высокая на велосипеде.
Более высокая температура — большая емкость, больший саморазряд и износ аккумулятора.
Холодный Рабочие температуры
Ячейки с температурами ниже 4ºC (40ºF) имеют высокое внутреннее сопротивление во время перезарядки. Напряжение элемента будет быстро расти, и как только он превысит 2,35 В на ПК, начнется выделение газа. Это вызывает чрезмерную потерю воды и коррозию пластин. Установку напряжения следует увеличивать при более низких температурах окружающей среды.Если не увеличить регулировку напряжения зарядного устройства, аккумулятор не будет заряжаться в течение 8–9 часов. Скорее всего, аккумулятор будет работать в частично заряженном состоянии. Это увеличивает риск сульфатации аккумулятора, что вызывает дальнейшие проблемы с подзарядкой, что значительно усугубляет проблему.
Подводя итог:
При низких рабочих температурах:
1 — Понимать, что емкость аккумулятора будет ниже
2 — Не позволяйте аккумулятору разряжаться до удельного веса при замерзании может образоваться электролит
3 — Увеличьте настройки регулирования напряжения и время перезарядки
Горячий Рабочие температуры
При рабочих температурах горячей окружающей среды следует избегать температуры ячеек, превышающей 43ºC (110ºF).Заряжаемый аккумулятор будет испытывать повышение температуры элемента примерно на 10 ° C в диапазоне окружающей среды 35 ° C (95 ° F). Следует более внимательно следить за зарядкой при температуре> 95 ° F. Следует уменьшить токи зарядки или остановить зарядку до тех пор, пока аккумулятор не остынет, если превышено значение 43 ° C (110 ° F)
, поскольку при температуре 52 ° C (125 ° F) могут возникнуть очень серьезные повреждения.
Батареи при разряде выделяют тепло. Это тепловыделение умеренное и не является проблемой при нормальных условиях разряда.Однако при очень высокой скорости разряда следует избегать условий высокой температуры окружающей среды. При высокой скорости батарея быстро разряжается за 1-2 часа. Сочетание высоких температур окружающей среды выше 35 ° C (95 ° F) и высокой скорости разрядки может вызвать серьезное повреждение аккумулятора. Таких высоких скоростей разряда можно избежать, используя аккумулятор большей емкости.
При высоких рабочих температурах:
1 — Не допускайте, чтобы температура элементов превышала 43 ° C (110 ° F)
2 — Дайте аккумулятору остыть при достижении 43 ° C (110 ° F)
3 — Избегайте очень тяжелых нагрузок чтобы избежать быстрой разрядки.
Водный цинк-ионный аккумулятор для сверхнизких температур
Замерзание водных электролитов серьезно ограничивает работу водных цинково-ионных батарей (AZIB) в условиях низких температур из-за ужасной ионной проводимости и кинетики границы раздела фаз. Здесь 4 M Zn (BF 4 ) 2 электролит с низкой температурой замерзания (−122 ° C) и высокой ионной проводимостью (1,47 мСм см −1 при −70 ° C. ) разработан для АЗИБов.Всесторонний анализ, включая спектроскопические измерения и теоретические расчеты, демонстрирует, что введение анионов BF 4 — может разрушить сети водородных связей в исходных молекулах воды за счет образования водородных связей OH ⋯ F, что приводит к сверхнизкому Точка замерзания. Электролит на основе 4 M Zn (BF 4 ) 2 позволяет батарее Zn // тетрахлорбензохинон (TCBQ) демонстрировать отличные электрохимические характеристики в широком диапазоне температур от 25 до -95 ° C, достигая высокая разрядная способность 63.5 мА · ч · г −1 и удельной энергии 76,2 Вт · ч · кг −1 при рекордной температуре −95 ° C. Эта работа обеспечивает простую и экологически чистую стратегию разработки высокопроизводительных AZIB в условиях низких температур.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова?Металлические ионные аккумуляторные батареи на водной основе, работающие при отрицательных температурах
Adv Sci (Weinh). 2020 Янв; 8 (1): 2002590.
, 1 , , * , 1 , 1 , 1 , 1 , 2 , 1 , 1 , 1 и 1 , 3 *Ювэй Чжао
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
Зе Чен
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
Funian Mo
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
Донгхонг Ван
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
Инь Го
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
Чжуосинь Лю
2 Колледж материаловедения и инженерии, Шэньчжэньский университет, Шэньчжэнь 518060 Китай,
Синьлян Ли
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
Цин Ли
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
Гоцзинь Лян
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
Чуньи Чжи
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
3 Центр функциональной фотоники, Городской университет Гонконга, Коулун 999077 Гонконг,
1 Департамент материаловедения и инженерии, Городской университет Гонконга, Гонконг 999077 Китай,
2 Колледж материаловедения и инженерии, Шэньчжэньский университет, Шэньчжэнь 518060 Китай,
3 Центр функциональной фотоники, Городской университет Гонконга, Коулун 999077 Гонконг,
Автор, ответственный за переписку.Поступило 07.07.2020; Пересмотрено 7 сентября 2020 г.
Авторские права © 2020 Авторы. Опубликовано Wiley ‐ VCH GmbH Это статья в открытом доступе в соответствии с условиями http://creativecommons.org/licenses/by/4.0/ Лицензии, которая разрешает использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы. .Abstract
Водные перезаряжаемые металло-ионные батареи (ARMB) представляют собой один из современных исследовательских рубежей из-за их низкой стоимости, высокой безопасности и других уникальных характеристик.Превратившись в практически полезное устройство, ARMB должны адаптироваться к различным условиям окружающей среды, особенно к холодной погоде. Хотя много усилий было приложено к батареям с органическим электролитом, работающим при низких температурах, исследование низкотемпературных ARMB все еще находится в зачаточном состоянии. Проблема в основном возникает из-за замерзания воды при отрицательных температурах, что приводит к резкому замедлению кинетики. Здесь сначала обсуждается поведение воды при замерзании и его влияние на отрицательные характеристики ARMB. Затем суммируются все стратегии, используемые для улучшения характеристик ARMB при отрицательных температурах путем их связывания с кинетикой батареи.Сравниваются характеристики АРМБ и батарей с органическим электролитом при отрицательных температурах. В последнем разделе представлены потенциальные направления для дальнейших улучшений и перспективы на будущее в этой процветающей области.
Ключевые слова: водные батареи, низкотемпературные батареи, низкотемпературные аккумуляторы энергии, металло-ионные батареи, батареи при отрицательных температурах
Реферат
На основе поведения воды при замерзании и ее влияния на отрицательные характеристики водных перезаряжаемых металлов Ионные батареи (ARMB), стратегии, используемые для повышения отрицательных характеристик ARMB, путем связывания их с кинетикой батареи.Сравниваются отрицательные характеристики АРМБ и батарей с органическим электролитом. Представлены перспективы развития этого процветающего поля.
1. Введение
Аккумуляторные батареи широко используются в накопителях электроэнергии (EES) для устойчивого экономического и социального развития. [ 1 ] Поскольку потребность в накопителях энергии продолжает расти и появляется все больше и больше сценариев применения, батареи должны работать в экстремальных погодных условиях.Практически все типы аккумуляторов менее эффективны в холодных условиях, то есть срок службы, емкость и номинальная емкость аккумуляторов ухудшаются при низкой температуре. [ 2 ] В этом отношении расширение низкотемпературных диапазонов батарей имеет большое значение для повышения производительности EES и практических разработок, таких как эксплуатация летательных аппаратов, кибернаторов и подводных лодок. В настоящее время на рынке преобладают аккумуляторы на основе органических электролитов, соответственно, существует множество исследований низкотемпературных аккумуляторов с органическим электролитом. [ 3 ]
Водные перезаряжаемые металло-ионные батареи (ARMB) с характеристиками высокой безопасности, низкой стоимости, простоты сборки, высокой ионной проводимости и безвредности для окружающей среды рассматривались как многообещающие альтернативы для некоторых конкретных сценариев применения. например, хранение энергии в масштабе сети. [ 4 ] По сравнению со своими аналогами на основе органических электролитов, ARMB используют воду в качестве растворителя электролита, обладая следующими достоинствами: i) огнестойкость за счет водных электролитов, ii) легкость масштабирования за счет маневренности в воздухе, iii) потенциально лучшая двусторонняя эффективность объясняется более высокой ионной проводимостью водных электролитов, iv) относительно низкой стоимостью воды как растворителя и v) дружелюбием к окружающей среде. [ 5 ]
К сожалению, из-за замерзания воды ARMB, естественно, страдают от серьезного ухудшения рабочих характеристик при отрицательных температурах, что является результатом ухудшения как электролитов, так и материалов электродов. Основным механизмом плохой работы батарей ARMB при отрицательной температуре являются следующие: i) пониженная электронная проводимость и более медленная ионная диффузия материалов электродов; ii) более низкая ионная проводимость электролита; и iii) более медленная кинетика переноса заряда из-за уменьшения скорости химической реакции.Разумно, стратегии, разрабатываемые в настоящее время для улучшения низкотемпературных характеристик ARMB, в основном полагаются на улучшение электронно-ионной и кинетики реакции электролитов, электродов и других компонентов поддержки, включая сепараторы, связующие и токосъемники.
На данный момент не опубликовано ни одной обзорной статьи, посвященной подробному анализу и систематическому обзору прогресса в отношении ARMB, работающих при отрицательных температурах. Это захватывающий и необходимый обзор этой области исследований, чтобы изучить последние достижения и потенциальные рекомендации по улучшению низкотемпературных характеристик ARMB.Достижения инновационных электролитов, электрохимические свойства электродных материалов и функции других поддерживающих компонентов низкотемпературных ARMB подробно обсуждаются в следующих разделах. Оптимизация характеристик батарей в холодных условиях с учетом характеристик, присущих этим материалам, открывает благоприятные перспективы для сетевых приложений ARMB.
2. Водный раствор при отрицательной температуре
Водные растворы обычно считаются отличными проводниками электролита из-за уникальных диэлектрических и жидких свойств воды.Физические и химические изменения воды, происходящие при отрицательных температурах, создают множество проблем для низкотемпературной работы ARMB. Замерзание водного электролита, неэффективная ионная проводимость и недостаточная смачиваемость при низких температурах считаются основными причинами, приводящими к ухудшению характеристик аккумулятора. [ 2 , 6 ]
2.1. Замораживание воды
Учитывая большое влияние замерзания воды на свойства водных электролитов, мы сначала подробно остановимся на механизме фазового перехода воды при отрицательных температурах.Водородная связь (O: H — O) является основной структурой и единицей хранения энергии воды. Атомы водорода объединены водородными связями. Водородные связи образуют протяженную сеть между триллионами молекул, и эти связи продолжают разрываться и рекомбинировать. Когда вода остывает выше 4 ° C, кинетическая энергия ( E k ) молекул воды сокращает продолжительность взаимодействий друг с другом, заставляя водородные связи образовываться и быстрее разрушаться ( Рис. ). Когда температура ниже 4 ° C, E k молекул воды начинает опускаться ниже энергии водородных связей ( E H-связь ), в результате чего водородные связи образуются на гораздо более высоких частотах, чем они разрываются.Наконец, образуется твердая вода — лед (рисунок). [ 7 ]
Схема водного раствора при низкой температуре. a) Энергия, зависящая от температуры в чистой воде, где E k и E H-связь относятся к кинетической энергии и энергии водородных связей молекул воды соответственно. б) Кристаллические структуры воды и льда с водородными связями внутри. c) Зависящая от концентрации точка замерзания воды и трех солевых растворов.г) Температурная проводимость водного раствора высококонцентрированной соли. д) Вязкость и угол смачивания водного раствора, зависящие от температуры.
Таким образом, это общий подход к подавлению образования кристаллических решеток льда при отрицательной температуре путем наделения ионов электролита более прочными водородными связями с молекулами воды, конкурирующими с водородными связями в воде. [ 8 , ] Эта концепция широко применяется при разработке электролитов для АРМБ, работающих при отрицательных температурах.Использование высококонцентрированных (или насыщенных) растворов соли в воде позволяет эффективно снизить температуру замерзания воды на десятки градусов. [ 9 ] В простом описании падение температуры замерзания можно выразить уравнением
ΔTf = Twater − Tsoln = Kf · м
(1)
где Δ T f изменена точка замерзания, T вода — термодинамическая точка замерзания воды (0 ° C), T soln — температура замерзания раствора, K f — константа понижения точки замерзания, которая различна для каждого растворителя ( K f = 1.86 ° C кг моль для воды), и м — моляльность раствора ( -1 моль кг). Например, точка замерзания для 1 м раствора NaCl, MgCl 2 и Ca 3 (PO 4 ) 2 рассчитана как -3,7, -5,6 и -9,3 ° C (рисунок). [ 10 ] Процесс расчета для NaCl (обратите внимание, что существует 2 м ионов из ионов Na + и Cl — ) выглядит следующим образом.
ΔTf = 1,86 Ckgh3Omolчастиц · 1мольNaCl1kgh3O · 2мольчастиц1molNaCl = 3.7∘C
(2)
Tsoln = 0∘C − 3,7∘C = −3,7∘C
(3)
2.2. Свойство ионной проводимости и смачиваемости
В разбавленном солевом растворе снижение температуры замедляет движение держателей зарядного устройства в растворе, но проводимость может оставаться неизменной из-за ограниченного количества держателей зарядного устройства. Однако в высококонцентрированном солевом растворе проводимость может заметно уменьшаться с понижением температуры (рисунок). [ 11 ] Кроме того, вязкость электролита быстро увеличивается при низкой температуре (рисунок), что оказывает неблагоприятное воздействие на миграцию ионов и инфильтрацию электрода, в конечном итоге снижая быстродействие батареи. [ 12 ] Еще один фактор, который может повлиять на характеристики низкотемпературной батареи, заключается в том, что снижение температуры может ухудшить смачиваемость растворов, что проявляется в изменении угла смачивания (рисунок). Угол смачивания немного увеличится при понижении температуры из-за увеличения водородных связей и поверхностного натяжения. [ 13 ]
3. Стратегии для поддержания производительности ARMB при отрицательной температуре
В этом разделе будут представлены разработанные стратегии для поддержания электрохимических характеристик ARMB при отрицательной температуре, которые суммированы на рис. .Эти стратегии состоят из трех основных подходов: оптимизация электролита, конструкция электродов и другие неактивные компоненты техники. Следует отметить, что некоторые подходы считаются эффективными, и некоторые из них были приняты для систем органических батарей, но пока они не были продемонстрированы в ARMB. Эти подходы также обобщены и обведены пунктирными линиями на рисунке.
Краткое изложение стратегий проектирования для улучшения характеристик ARMB при отрицательных температурах.Подходы, обведенные пунктирной линией, считаются эффективными для ARMB, но не были продемонстрированы. Некоторые из них были адаптированы для батарей с органическим электролитом.
В соответствии с деградацией компонентов в ARMB при отрицательной температуре, эти подходы в основном используют преимущества следующих механизмов для достижения сохранения емкости при пониженной температуре: снижение температуры замерзания электролита, поддержание низкого сопротивления межфазной передаче заряда, поддержание высокой электропроводности электрод, поддерживающий высокую диффузионную способность электрода и электролита, а также улучшающий смачиваемость на поверхности раздела между электродом и электролитом.Мы суммируем подходы и соответствующие механизмы на рисунке Рисунок . Следует отметить, что во всех случаях один подход может выиграть от нескольких механизмов одновременно. Например, антифриз-гидрогелевый электролит может обеспечивать более низкую температуру замерзания электролита, при этом коэффициент диффузии ионов может поддерживаться на высоком уровне, а сопротивление межфазной передаче заряда может поддерживаться низким.
Краткое описание механизмов разработки этих стратегий для улучшения характеристик ARMB при отрицательных температурах.На схемах механизмов вверху слева и внизу слева показан электролит «вода в соли» LiTFSI (красная стрелка относится к неорганической фазе Li + -4 (H 2 O)) и добавку ДМСО (красная стрелка относится к HB, образованному между ДМСО-2 (H 2 O)) в качестве примеров, соответственно. HB здесь означает водородную связь.
3.1. Оптимизация водных электролитов
Электролит, как ионный проводник, имеет огромное значение для общей производительности ARMB. В следующих подразделах мы обсудим, как манипулировать электролитами для улучшения характеристик ARMB при отрицательных температурах.Это касается оптимизации состава растворителей, разработки альтернативных электролитов, использования многофункциональных добавок и гидрогелей антифризов. Доказано, что эти подходы осуществимы и эффективны.
3.1.1. Электролит «вода в соли»
Высококонцентрированные водные электролиты весьма полезны для обеспечения работы ARMB при отрицательных температурах. В настоящее время они применяются в водных литий-ионных батареях (ALIB), водных цинково-ионных батареях (AZIB), водно-калийных ионных батареях (AKIB) и металло-воздушных батареях.Полезные растворенные вещества в различных системах включают LiCl, KOH и объемные анионные соли, такие как бис (трифторметансульфонил) имид лития (LiTFSI) и его производные, а также трифторметансульфонат цинка (Zn (CF 3 SO 3 ) 2 ) и KCF 3 SO 3 .
Насыщенный раствор LiCl очень эффективен для поддержания рабочих характеристик ALIB при отрицательных температурах до -45 ° C. При использовании катода LiCoO 2 (LCO) сохранение емкости 72% может быть получено при -40 ° C.Это даже лучше, чем его аналоги с органическим электролитом. [ 10 ] Аналогичным образом, металло-воздушные батареи обычно предпочитают водный щелочной электролит с немного более высокой концентрацией (30–40% КОН) для применения при отрицательных температурах (до -30 ° C). [ 14 ] Объемные анионные соли также широко используются для АРМБ, работающих при отрицательных температурах. Водный раствор 21 моль (моль кг −1 ) LiTFSI и его производные обладают высокой электрохимической стабильностью благодаря молекулам воды сверхнизкой концентрации, почти все из которых сильно координированы с Li + и связаны анион-содержащим Li + сольватационные оболочки. [ 15 ] Сольватационные оболочки Li + приводят к образованию плотной межфазной границы на поверхности анода. Со всеми материалами электродов NASICON (Li 3 V 2 (PO 4 ) 3 / LiTi 2 (PO 4 ) 3 , LVP / LTP) и низкой температурой замерзания 21 м водного электролита LiTFSI, ALIB может обеспечить превосходную обратимую емкость 111 мАч g -1 при -20 ° C, что очень близко к 120 мАч g -1 при 25 ° C. [ 16 ] LiTFSI также используется в качестве усилителя концентрации, который способствует стабильности электролита. Типичная система представляет собой электролит из 1 м Zn (CF 3 SO 3 ) 2 + 21 м LiTFSI, который используется для достижения впечатляющих электрохимических характеристик AZIB при -15 ° C (60 мАч г −1 ). [ 17 ] Для AKIB, 22 м KCF 3 SO 3 водно-солевой электролит продемонстрировал свою эффективность. [ 18 ] При температуре до −20 ° C аккумулятор сохраняет 76% своей емкости (8,4 мАч). CE клетки-мешочка увеличивается почти до 99,9% (0,1 ° C) при -20 ° C из-за влияния более низкой температуры на меньшее количество побочных реакций. Недавно были разработаны новые водно-солевые электролиты на основе асимметричных анионов для предотвращения кристаллизации при отрицательных температурах. Асимметричные (фторсульфонил) (трифторметансульфонил) имид (FTFSI) и (пентафторэтансульфонил) (трифторметансульфонил) имид (PTFSI) анионы препятствуют образованию электролитов с высокой концентрацией дальнего порядка, эффективно подавляя кристаллизацию. [ 19 , 20 ] Путем дальнейшего смешивания NaFTFSI с другими анионными солями (NaFSI) жидкое состояние водно-солевых электролитов может быть увеличено до -14 ° C. [ 20 ]
С точки зрения механизма, точка замерзания электролита «вода в соли» может быть значительно снижена с точки зрения термодинамики. Путем выбора подходящих солей ионная проводимость электролита «вода в соли» также может прилично поддерживаться при отрицательной температуре, хотя более низкой ионной проводимости нельзя избежать.Кроме того, образование стабильной и проводящей межфазной фазы твердый электролит на основе анода (SEI) полезно для ускорения фазового переноса ионов металлов и уменьшения сопротивления переносу заряда. [ 21 год ] Примечательно, что для LiCl была достигнута на два-три порядка более высокая проводимость в водном электролите, чем в его аналогах с органическими электролитами. [ 2 , 22 ] Эти факторы, несомненно, способствуют возникновению ARMB при отрицательных температурах.Кроме того, электролит «вода в соли» также дает ARMB следующие достоинства: i) уменьшение растворения электродов и коррозии металла, дальнейшее улучшение стабильности активных материалов и электролита по сравнению с разбавленными растворами; [ 23 ] ii) расширение потенциального окна; [ 24 ] iii) стимулирование электродных реакций; [ 25 ] iv) увеличение числа переноса ионов металлов, [ 26 ] и v) подавление воспламеняемости и парообразования. [ 27 ] Эти особенности значительно улучшают работу ARMB в холодных условиях. С другой стороны, это все еще принципиально сложно, но технически важно для преодоления внутренних ограничений электролитов «вода в соли» в будущем, включая низкую проводимость, высокую вязкость в результате сильного взаимодействия катион-анион иона, соли осадки при понижении температуры и дороговизна.
3.1.2. Сорастворители или добавки
По сравнению с традиционным SEI водный SEI возникает в результате восстановления солевых анионов в вышеупомянутых «вода-в-солевых» электролитах, страдающих от серьезной «катодной проблемы».Это объясняется отталкиванием анионов отрицательно поляризованными поверхностями анода. [ 28 год ] Таким образом, рентабельное расширение катодного предела водного электролита также очень важно для повышения производительности ARMB при отрицательных температурах. С точки зрения термодинамики, жидкий диапазон электролитов может быть расширен, и приличная ионная проводимость может поддерживаться путем добавления сорастворителей или добавок с низкой температурой плавления и низкой вязкостью. [ 29 ] В последние годы «гибридный водный / неводный электролит» обозначает новый класс сорастворителей, сохраняющих неотъемлемые преимущества как водных, так и неводных растворителей, потенциально разрешая конфликты между стоимостью, межфазной химией, безопасностью и низкотемпературными характеристиками. [ 30 ] С другой стороны, последние достижения в области низкотемпературных добавок в основном сосредоточены в области неводных батарей, а добавки, применяемые в водных батареях, находятся на начальной стадии. [ 31 год ] Эффективность добавок для расширения низкотемпературного диапазона ARMB в значительной степени зависит от способности снижать точку замерзания электролита за счет ингибирования образования регулярных водородных связей во льду (рисунок). Следует отметить, что термины «сорастворители» и «добавки» широко используются в исследованиях. Основное различие заключается в используемой дозировке (к сожалению, строго не определенной в опубликованных исследованиях), но они обычно имеют очень похожие механизмы. [ 32 ] Поэтому мы обсуждаем их обоих в одном разделе. Для удобства мы используем термин «добавка», чтобы проиллюстрировать следующий контекст. Обычные добавки, используемые в водном электролите, включают ацетонитрил (AN), диметилсульфоксид (DMSO) и этиленгликоль (EG).
AN обладает такими достоинствами, как низкая температура замерзания (-48 ° C), высокая диэлектрическая проницаемость (35,9), превосходная химическая и окислительная стабильность (> 5 В по сравнению с Li + / Li) и высокая смешиваемость.Совместное использование AN в водно-солевом электролите, таком как гибридный электролит «AN / 21 м LiTFSI в воде» (AN-WiSE), может обеспечить значительно улучшенную ионную проводимость, пониженную вязкость и пониженную температуру замерзания по сравнению с электролит 21 м LiTFSI в воде. [ 33 ] Это связано с тем, что пространственная изоляция, приписываемая молекулам ацетонитрила, и поддерживаемая прочная координация между молекулами H 2 O и Li + приводят к ослаблению электростатического катион-анионного притяжения.Кроме того, гибридный водный / неводный и концентрированный электролит «AN и вода (молярное соотношение 1: 1) в соли» (BSiS-A 0,5 ) демонстрирует явно высокую активность сольватационной структуры AN-2Li + при электрохимическом восстановлении. . Преобладающие разновидности неорганической фазы Li + -4 (H 2 O) и быстрый обмен органической фазы AN способствуют быстрой проводимости Li + , более низкой температуре замерзания, а также лучшей смачиваемости ( Рисунок ). [ 10 , 34 ] Аккумулятор LiMn 2 O 4 / Li 4 Ti 5 O 12 с использованием BSiS ‐ A 0.5 обеспечивает разрядную емкость 110 мАч g −1 (сохранение емкости 76%) после 120 циклов при 0 ° C, о чем свидетельствует гораздо более низкое сопротивление переносу заряда в BSiS ‐ A 0,5 при 0 ° C.
Улучшение характеристик low- T за счет применения присадок. a) Ионная проводимость гибридных электролитов «бисрастворитель (вода и ДМК) в соли» BSiS-D 0,28 и «бисрастворитель (вода и AN) в соли» BSiS-A 0,5 при различных температурах (-20 до 60 ° С). Воспроизведено с разрешения автора. [ 68 ] Авторские права 2019, Wiley ‐ VCH. б) Исследование ионной проводимости в зависимости от температуры. c) Циклические характеристики NaTi 2 (PO 4 ) 3 @C (NTP) / 2 м NaClO 4 водный электролит с ДМСО, χ ДМСО = 0,3 (2 м-0,3) / активированный уголь (AC) и NTP / 2 м-0 / батареи переменного тока при -50 ° C. Воспроизведено с разрешения автора. [ 6 ] Авторские права 2018, Wiley ‐ VCH. г) Испытание ДСК на водных электролитах с ЭГ при различных массовых долях 0, 5, 10, 20 и 40 мас.%.д) Температурно-зависимая ионная проводимость 1 м электролита Li 2 SO 4 с различными массовыми долями ЭГ и 1 м органического электролита LiPF 6 в EC / DEC (1: 1, об. / об.). f) Скоростная способность батареи LiFePO 4 (LFP) / переменного тока на 1 м Li 2 SO 4 с различными массовыми долями ЭГ при -20 ° C. Воспроизведено с разрешения автора. [ 67 ] Авторские права 2019, ACS.
Используя ДМСО в качестве добавки, можно получить электролит с температурой замерзания ниже -130 ° C и замечательной ионной проводимостью 0.11 мСм см -1 при -50 ° C (рисунок). [ 6 ] При добавлении ДМСО водородные связи между молекулами воды значительно ослабляются и, напротив, водородные связи между водой и молекулами ДМСО становятся намного сильнее. [ 35 год ] Также, 2 м-0,3 (2 м NaClO 4 водный электролит с ДМСО, χ ДМСО ( = 0,3) является достаточно стабильным для образования водородных связей ДМСО-вода, и большинство его молекул собираются в виде 2-воды-1-ДМСО, что предотвращает образование в смеси упорядоченной кристаллической структуры (льда) при низкой температуре и, таким образом, способствует образованию понижение точки замерзания. [ 36 ] При использовании 2 м-0,3 аккумулятор NaTi 2 (PO 4 ) 3 @C (NTP) / 2 м-0,3 / активированный уголь (переменный ток) демонстрирует превосходные характеристики при езде на велосипеде при -50 ° C (рисунок).
Среди различных присадок к антифризу хорошо известная EG находит множество практических применений в электронике и автомобилях. Перспективный подход к улучшенным низкотемпературным характеристикам ALIB был разработан с использованием EG. При увеличении количества ЭГ (0–40 мас.%) В 1 м электролита Li 2 SO 4 температура кристаллизации снижается с −4.От 6 до -24,6 ° C (рисунок). Кроме того, лучшая низкотемпературная способность батареи LiFePO 4 (LFP) / переменного тока достигается на 1 м Li 2 SO 4 с 40 мас.% ЭГ при -20 ° C благодаря улучшенному ионному подвижность по нижней точке замерзания (рисунок,). Аналогичным образом гибридный электролит EG и ZnSO 4 был применен в водных батареях Zn // PANI ‐ V 2 O 5 . [37] Водородная связь между EG и H 2 O значительно усиливается за счет уникального сольватационного взаимодействия между EG и Zn 2+ , которое придает гибридному электролиту низкую температуру замерзания -33 ° C.В частности, аккумулятор сохраняет 72% (130 мАч g −1 ) своей емкости при комнатной температуре при −20 ° C.
Кроме того, добавление добавок в электролит Zn-воздушных аккумуляторов может также уменьшить побочные реакции, такие как реакция выделения водорода. [ 38 ] Добавка адсорбируется на активных участках выделения водорода, снижая растворимость Zn (OH) 4 2- и дополнительно ингибируя осаждение ZnO. [ 39 ] Этот подход улучшает эффективность анодной реакции и снижает внутреннее сопротивление, что также способствует работе Zn-воздушных батарей при отрицательных температурах.
Есть еще много возможностей для изучения других добавок с низкой температурой плавления и низкой вязкости, таких как диэтилкарбонат (DEC), метилпропилкарбонат (MPC), метилэтилкарбонат (EMC) и пропиленкарбонат (PC) для разработки. экономичные дружественные низкотемпературные АРМБ, работающие при отрицательных температурах. Кроме того, введение органических добавок в ARMB имеет большое значение для создания SEI, который может эффективно адаптироваться к низкотемпературным средам, сохраняя достоинства водных и неводных растворителей.Следует отметить, что обычно следует выбирать очень безопасные органические добавки, то есть люди не хотят преувеличивать уникальную природу безопасности ARMB для достижения их низкотемпературных характеристик.
3.1.3. Гидрогели
За исключением корректировки состава электролита, разработка гидрогелей, сшитой сетки из гидрофильных полимерных цепей, диспергированных в воде, также способствует уменьшению проблемы растворения электродов и уменьшению ухудшения характеристик батареи при отрицательных температурах.Гидрогели с невысыхающими и антифризными (AF) свойствами достигли значительного прогресса в последние годы, что дает возможность применять гидрогели в низкотемпературных ARMB. Введение криопротекторов (CPA) с низким испарением, таких как EG, [ 40 ] глицерин, [ 41 год ] сорбит и масло [ 42 , ] в гидрогели является эффективным методом предотвращения потери воды и подавления обледенения воды. Следует особо отметить, что с помощью антифриза-гидрогелевого электролита можно изготавливать гибкие квазитвердотельные батареи, работающие при отрицательных температурах, за счет сохраняющейся гибкости разработанных гидрогелей при отрицательных температурах.
Был разработан простой, надежный и универсальный подход, заключающийся в замене растворителя для производства антифриза на основе CPA-глицеринового гидрогеля на Ca-альгинат / полиакриламид (PAAm), работающий при -50 ° C ( Рисунок -). [ 43 год ] Кроме того, в гибкой батарее Zn / MnO 2 был разработан водный анионный полиуретанакрилатный гидрогелевый электролит (EG-waPUA) на основе EG. [ 44 ] Удельная емкость батареи AF сохраняет 74.54% за 600 циклов при -20 ° C с приближением CE к 100% (рисунок -). Общая связь между вышеупомянутыми гидрогелями AF заключается в том, что сильные водородные связи, образованные между глицерином (или EG) и молекулами воды, заметно снижают точку замерзания и сохраняют высокую проводимость при отрицательной температуре. [ 45 ] Другой класс гидрогелей основан на коллигативном свойстве ионных соединений, таких как хлорид кальция (CaCl 2 ), ингибировать кристаллизацию ледяной водной фазы. [ 46 ] Кроме того, поскольку взаимодействие между концевыми группами полимерного скелета, ионами электролита и водой имеет большое влияние на характеристики AF гидрогелевых электролитов, введение групп, которые могут сильно взаимодействовать с водой, в цепь гидрогеля также снижает температуру замерзания. гидрогелевого электролита. [ 47 ] Преобразование концевой группы цепей полиакриловой кислоты в солевую форму (гидрогель A-PAA) для получения более сильной электростатической силы притяжения значительно препятствует замерзанию воды, и, таким образом, изготовленная воздушно-цинковая батарея демонстрирует высокую емкость. сохранение 92.7% (691 мАч г -1 ) при -20 ° C. [ 48 ] Также был предложен другой модифицированный полидофамином (PDA) углеродные нанотрубки, привитые глицерин-водным гидрогелем (GW-гидрогель), который выигрывает от ковалентных / нековалентных взаимодействий в полимерных цепях глицерин-вода и синергетически армирующих углеродных нанотрубок. [ 41 год ] Вязкие глицериновые и катехиновые группы из КПК придают гидрогелю GW высокую вязкость ткани (Рисунок -).Примечательно, что эти гидрогели AF являются механически гибкими и могут выдерживать различные большие деформации (например, скручивание, сжатие и растяжение) даже при отрицательных температурах. Таким образом, были разработаны гибкие ARMB, работающие при отрицательных температурах, с сохранением как электрохимических характеристик, так и механической прочности.
Улучшение характеристик низкого уровня T за счет использования гидрогелей. а) Схема приготовления жестких органогидрогелей заменой на месте жестких гидрогелей криопротекторами (CPAs).б) Фотографии механической деформации антифриза (AF) глицериновых гидрогелей при −50 ° C в сложенном и скрученном состояниях. c) Изменение веса вязких гидрогелей глицерина, хранящихся при влажности 50% и температуре 20 ° C. Воспроизведено с разрешения автора. [ 43 год ] Авторские права 2018, Wiley ‐ VCH. г) Фотографии механической деформации AF-геля при −20 ° C в изогнутом и скрученном состояниях. e) Стабильность циклического режима АКБ при 2,4 A g –1 и различных температурах. е) Фотография квазитвердых гибких батарей AF, работающих при -20 ° C.Воспроизведено с разрешения автора. [ 44 ] Авторские права 2015, RSC. g) Принципиальная схема гидрогеля глицерин-вода (гидрогель GW) с модифицированными полидофамином (PDA) углеродными нанотрубками (УНТ), хорошо диспергированными в кислотных (PAM- co -PAA) сетках. з) Фотографии гидрогеля GW после охлаждения при -20 ° C в течение 24 ч в скрученном, сжатом и вытянутом состояниях. i) Зависимое от времени изменение веса гидрогеля GW и водного гидрогеля (гидрогель W). Вт 0 и W т. — это начальный вес и вес в реальном времени в определенное время соответственно.Воспроизведено с разрешения автора. [ 41 год ] Авторские права 2017, Wiley ‐ VCH.
Следует отметить, что стратегия гидрогелей обычно используется в сочетании с сорастворителями, добавками или высококонцентрированными солями для дальнейшего расширения низкотемпературного диапазона электролитов. Например, обычно описываемый гидрогелевый электролит, содержащий высококонцентрированные соли, позволяет использовать батареи с антифризными свойствами, [ 49 ] с высокой проводимостью, [ 17 , 50 ] и отличными механическими свойствами.
3.2. Электрод и неактивный компонент
В качестве центров переноса катионов металлов и электронов электроды также имеют решающее значение для ARMB, работающих при отрицательных температурах. Как правило, низкотемпературные характеристики электродов страдают от собственной вялой кинетики, которую приписывают более низкой, чем обычно, электронной проводимости и способности к диффузии ионов. Электрохимические свойства электродов связаны с кинетическим коэффициентом диффузии, энергией активации диффузии и способностью уменьшать сопротивление переносу заряда, которое во многом зависит от структурных характеристик электродов.Стратегия увеличения расстояния между слоями и увеличения удельной площади может эффективно подавить ухудшение характеристик электродов при отрицательных температурах. Отчеты, касающиеся введения структурной воды или радикалов или ионов металлов и изготовления нанопористой структуры, обсуждаются в следующих разделах.
С другой стороны, несмотря на то, что были проведены ограниченные исследования низкотемпературных электродов, существует множество исследований по стратегиям улучшения характеристик электродов при комнатной температуре.Считается, что эти стратегии также будут полезны для улучшения их характеристик при отрицательных температурах благодаря преимуществам диффузии ионов или проводимости электродов.
3.2.1. Катод
Ванадиевые материалы широко используются в качестве катодов для ARZB, а их слоистая структура может быть расширена для улучшения электрохимических характеристик даже при низких температурах. [ 51 ] Например, внедренные ионы аммония и кристаллическая вода расширяют интервал решетки V 3 O 8 , обеспечивая достаточное диффузионное пространство для гостевого Zn 2+ .Он обеспечивает превосходную стабильность скорости и поддерживает 120 мАч g −1 (сохранение емкости 32%) при -20 ° C благодаря улучшенному кинетическому переносу Zn 2+ , даже быстрее, чем диффузия Li + в LiV 3 Катоды O 8 и LiFePO 4 ( Рисунок ,). [ 51 , 52 ] Другая стратегия легирования ионов металлов (Fe 2+ , Co 2+ , Ni 2+ , Mn 2+ , Zn 2+ и Cu 2+ ) в V 2 O 5 (VO) катод для AZIB на основе ванадия также обеспечивает улучшенную способность к диффузии ионов, электронную проводимость и структурную стабильность во время цикла при 0 ° C, что позволяет получить отличные электрохимические характеристики с сохранением емкости 80% (рис. ). [ 53 , ] Следует отметить, что наноструктурирование и нанесение покрытия или гибридизация проводящих материалов также полезны для улучшения отрицательных характеристик. [ 54 ] Водный двухионный аккумулятор, состоящий из нано / микроструктурированного Ni (OH) 2 катода и покрытого углем NaTi 2 (PO 4 ) 3 анода, сохраняет высокую емкость 85% после 10 000 циклов при −20 ° C в 2 м электролите NaClO 4 . [ 55 ]
Повышение производительности при низком уровне T за счет оптимизации материалов электродов. а) Скоростная способность при плотностях тока от 0,1 до 1 А г −1 с последующим циклированием Zn // (NH 4 ) 2 V 6 O 16 ⋅1,5H 2 O ( NVO) при 1 A g −1 и −20 ° C. б) Коэффициент диффузии Zn 2+ ( D ) во втором цикле НВО. Воспроизведено с разрешения автора. [ 51 ] Авторские права 2019, Elsevier. c) Скоростная способность при плотностях тока от 0,5 до 10 А г −1 с последующим циклированием Cu x V 2 O 5 · n H 2 O (отожженный при 300 ° C, CuVO ‐ 300) при 5 A g −1 и 0 ° C. г) D Zn 2+ в процессах разряда / заряда в третьем цикле преинтеркалированных ионов переходных металлов V 2 O 5 (TVO) -300 и V 2 O 5 (VO ) ‐300.Воспроизведено с разрешения автора. [ 53 ] Авторские права 2019, Elsevier. д) Схематическое изображение конфигурации воздушно-цинковой батареи и образования льда при низких температурах. Воспроизведено с разрешения автора. [ 56 ] Авторские права 2018, ACS.
Хотя исследования низкотемпературных катодов для ARMB очень ограничены, улучшение смачиваемости катодов — широко используемые подходы в низкотемпературных LIB с органическими электролитами, которые могут вдохновить на исследования ARZB при отрицательных температурах в ближайшем будущем. [ 2 ] Кроме того, необходимо исследовать некоторые новые материалы с высокой электронной и ионной проводимостью при низких температурах, такие как топологические материалы и дефектные полупроводниковые материалы.
3.2.2. Анод
Помимо упомянутого выше прогресса в области катодных материалов, анод также имеет жизненно важное значение для низкотемпературных характеристик ARMB. Было обнаружено, что использование нанопористого цинкового анода эффективно для улучшения низкотемпературных характеристик воздушно-цинковой батареи (рисунок). [ 56 ] Уменьшение точки замерзания водного раствора, захваченного в поре, можно представить как функцию радиуса поры ( r ) и концентрации, [ 57 ] , а функция является неидеальной формой уравнения Гиббса – Томсона следующим образом:
Tm, 1 − T = 2v1SσSLTm, 1cosθrΔh2fus1 + RTm, 1π∼Δh2fus + Rπ∼Tm, 12 / Δh2fus1 + Rπ∼Tm, 1 / Δh2fus
(4)
90 где T m, 1 и T представляют собой точку плавления чистой воды при объемном давлении фазы и точку замерзания водного раствора соответственно.v1S относится к молярному объему чистой воды в твердой фазе при T м, 1 и давление жидкой фазы ( P L ). R , σ SL и θ — универсальная газовая постоянная, межфазное натяжение льда и раствора и краевой угол между стенкой отверстия и границей раздела твердое тело – жидкость, соответственно. Δh2fus и π∼ — осмольная доля раствора и молярная энтальпия плавления чистой воды при T м, 1 и P L соответственно.Неидеальность решения для многоуровневых растворов может быть предсказана из табличных свойств одного растворенного вещества с использованием формы Эллиотта и его сотрудников осмотического вириального уравнения [ 57 ]
π∼ = ∑i = 2zki ∗ xi + ∑i = 2z∑j = 2zBii ∗ + Bjj ∗ 2ki ∗ xikj ∗ xj + ∑i = 2z∑j = 2z∑k = 2zCiii ∗ Cjjj ∗ Ckkk ∗ 1 / 3ki ∗ xikj ∗ xjkk ∗ xk + ···
(5)
, где i , j , k = 2 и z относится к z −1 растворенным в растворе. x i , Bii ∗ и Ciii ∗ — мольные доли, второй и третий основанные на мольной доле осмотические вириальные коэффициенты растворенного вещества i , соответственно. Второй осмотический вириальный коэффициент и третий осмотический вириальный коэффициент относятся к взаимодействиям между двумя молекулами растворенного вещества – и взаимодействиям между тремя молекулами растворенного вещества –, соответственно, и т. Д. Если растворенное вещество – является термодинамически идеальным, то эти коэффициенты равны нулю. .Для растворенных веществ электролита концентрацию растворенного вещества необходимо умножить на ki ∗ (основанная на мольной доле константа диссоциации растворенного вещества i ). В частности, при понижении температуры в электролите образуется лед. Однако образование или распространение льда в порах двух электродов требует более низких температур, чем неограниченный электролит, согласно уравнениям (4) и (5). Результаты расчетов показывают, что капиллярная пора диаметром 10 нм может снизить температуру локального замерзания электролита на ≈10 ° C.Таким образом, характеристики электролита можно регулировать, создав пористую структуру и уменьшив размер частиц электродов. Однако четкой экспериментальной демонстрации эффективности этого подхода пока нет. Подобно катодным исследованиям, исследования по разработке низкотемпературных анодов также очень ограничены, особенно когда используется металлический анод. Однако заслуживает внимания опыт улучшения характеристик анодов аккумуляторных батарей с органическим электролитом при низких температурах.Например, композитный катод Li 3 V 2 (PO 4 ) 3 / C (LVP / C) демонстрирует емкость обратимого разряда 108,1 мАч г -1 (сохранение емкости 86,7%) при — 20 ° C с традиционным органическим электролитом с использованием модифицированного электрода. [ 58 ] На основании вышеуказанных данных мы предполагаем, что низкотемпературные характеристики ARMB также могут быть улучшены за счет легирования ионов металлов в электродах.
3.2.3. Неактивный компонент
Кроме того, исправность неактивных компонентов также имеет решающее значение для поддержания низкотемпературной работы батареи. Хотя имеется очень ограниченное количество отчетов о влиянии температуры на электрохимически неактивные компоненты в ARMB, некоторые исследования были проведены для батарей с органическим электролитом, и можно получить ценный опыт. Подходы, включающие использование многофункциональных связующих, модификацию сепараторов и оптимизацию токосъемников, помогают поддерживать работу аккумуляторной батареи при отрицательных температурах.Инженерный сепаратор с повышенной проницаемостью, [ 59 , ] и наделение токосъемника превосходной площадью контакта и проводимостью полезны для уменьшения сопротивления переносу заряда и содействия переносу ионов. [ 60 ] Все они успешно продемонстрированы в аккумуляторах с органическим электролитом. Как правило, считается, что введение наноразмерных пор в сепаратор и токоприемник также может изменить поведение ARMB при замораживании на основе ранее упомянутого многоуровневого осмотического вириального уравнения Эллиоттом и сотрудниками. [56b, 60 ] Эти универсальные методы могут вдохновить на разработку неактивных компонентов в ARMB, работающих при отрицательных температурах.
4. Резюме производительности с упором на сравнение
В настоящее время понимание механизма снижения производительности органических батарей при низких температурах все еще ограничено, но технологические проблемы частично объясняются присущими кинетическим ограничениям, аналогичными ограничениям ARMB, например сопротивление переносу заряда, ионная проводимость и температура плавления электролита.Традиционные органические электролиты LIB имеют более медленный перенос ионов при низких температурах, что приводит к плохим характеристикам батарей при низких температурах. [ 61 , ] Кроме того, высокие штрафы за десольватацию, связанные с сильным кулоновским отталкиванием на границе раздела и высокими энергиями активации, наряду с большим межфазным импедансом переноса заряда в батареях с органическим электролитом, накладывают ограничения на возможности скорости. [ 62 ] Таким образом, стратегии улучшения низкотемпературных характеристик батарей с органическим электролитом в основном сосредоточены на улучшении электродных материалов, электролитов и других поддерживающих компонентов для украшения контактных поверхностей, [ 32 , ] и производить более стабильную и проводящую межфазную поверхность SEI / катодный электролит, что в конечном итоге помогает облегчить фазовый перенос ионов металлов и снизить сопротивление переносу заряда. [ 21 год , 63 ]
Заявленное сохранение емкости в зависимости от температуры для типичных ARMB и батарей с органическим электролитом показано в обобщенном виде на Рис. . Лучший рекорд 98% в настоящее время в ARMBs реализован в LiFePO 4 // 2 моль л -1 ZnSO 4 + 1 моль л -1 LiCl в гидрогеле PAAm // система Zn при -20 ° С, [ 64 , ] , заслуживший от комбинированной стратегии высокой концентрации соли и гидрогеля.Самая низкая температура для системы ARMBs наблюдается при -50 ° C (сохранение емкости 61%), что реализуется в активированном угле // 2 м NaClO 4 + 0,3 X ДМСО // NaTi 2 (PO 4 ) 3 @C система с добавкой ДМСО. Еще одна достойная производительность достигается в батарее LiCoO 2 // насыщенный LiCl // Li 0,75 CoO 2 с сохранением емкости 72% при -40 ° C. Кроме того, лучший показатель 99% в органических системах достигается в нано-LiFePO 4 / C // 1 м LiPF 6 в системе EC + DMC // Li при −20 ° C. [ 65 ] Следует отметить, что многие батареи с органическим электролитом достигают приличных низкотемпературных характеристик при ≤ −30 ° C, в то время как данные ARMB в основном сконцентрированы при температуре ≥ −20 ° C. Это связано с тем, что органические системы, естественно, имеют более низкие точки замерзания, чем водные аналоги. Подробные характеристики типичных отрицательных характеристик ARMB, включая ALIB, ASIB, AKIB, AZIB и щелочные батареи, приведены в таблице Table .
Относительная зависимость сохранения емкости от температуры для типичных ARMB, [ 7 , 14 , 17 , 33 , 38 , 39 , 43 год , 51 , 52 , 53 , 54 , 55 , 56 , 57 , ] и батареи с органическим электролитом. [ 54 , 58 , 60 , 65 , 66 ] Различные формы точек используются для обозначения различных механизмов, а ноты для каждой точки являются ключевыми материалами, используемыми для достижения низкотемпературных характеристик.
Таблица 1
Сводка характеристик типичных ARMB при отрицательных температурах
| Катод | Анод | Электролит | T [° C] | Удельная емкость [мАч г −1 ] | Сохранение емкости относительно емкости RT / емкости RT | Сохранение емкости / циклов (количество циклов) | Оцениваемая способность [мАч г −1 ] |
|---|---|---|---|---|---|---|---|
| ALIB | |||||||
| LiCoO 2 [ 10 ] | Li 0.75 CoO 2 | Насыщенный LiCl | −40 | 65 при 0,2 ° C | 72% (90) | — | 42 при 0,5 ° C |
| Nano ‐ LiFePO 4 [ 67 ] | Активированный уголь | 1 м Li 2 SO 4 + 40 мас.% EG | −20 | 80 при 0,2C | — | 65% (100) | 35 при 1C |
| LiMn 2 O 4 [ 68 ] | Li 4 Ti 5 O 12 | LiTFSI в AN / H 2 O сорастворитель | 0 | 116 при 1C | 71% (163) | 95% ( 120) | — |
| LiFePO 4 [ 69 ] | Mo 6 S 8 | 21 м LiTFSI | -10 | 23 при 0.2C | 56% (41) | — | — |
| Li 3 V 2 (PO 4 ) 3 [ 16 ] | LiTi 2 (PO 4 ) 3 | 21 м LiTFSI | −20 | 111 при 0,2C | 92,5% (120) | — | 66,7 при 6C |
| ASIB | |||||||
| Ni (OH) 2 [ 55 ] | NaTi 2 (PO 4 ) 3 @C | 2 м NaClO 4 | -20 | 70 при 10C | 73.7% (95) | 85% (10 000) | — |
| Активированный уголь [ 6 ] | NaTi 2 (PO 4 ) 3 @C | 2 м NaClO 4 + 0,3 Х ДМСО | −50 | 68 при 0,5 ° C | 61% (111) | 94,3% (100) | 46 при 10 ° C |
| AKIB | |||||||
| KFeMnHCF ‐ 3565 [ 18 ] | PTCDI | 22 м KCF 3 SO 3 | −20 | 8.5 мАч при 0,1C | 77,3% (11 мАч) | — | 9,1 мАч при 0,5 ° C (-10 ° C) |
| AZIB | |||||||
| α ‐MnO 2 / CNT [ 44 ] | Zn | 2 м ZnSO 4 + 0,1 м MnSO 4 в гидрогеле EG ‐ waPUA / PAM | −20 | 226 по адресу 0.2 А г −1 | 80,7% (243) | 74,54% (600) при 2,4 А г −1 | 106 при 2,4 А г −1 |
| LiMn 2 O 4 [ 50 ] | Zn | 0,5 моль л −1 Li 2 SO 4 + 0,2 моль л −1 ZnSO 4 в модифицированном силаном Zn-альгинате / органогидрогеле PAM | −20 | 60 по адресу 0.3 А г −1 | 64,4% (90) | 91,17% (100) | — |
(NH 4 ) 2 V 6 O 16 ⋅ 1,5H 2 O [ 51 ] | Zn | 3 м Zn (CF 3 SO 3 ) 2 | −20 | 120 при 0,1 А г −1 | 31,58% (380) | 98% (100) при 1 А г −1 | 41 при 1 А г −1 |
| CuVO [ 53 ] | Zn | 2 м ZnSO 4 | 0 | 320 по адресу 0.5 А г −1 | 80% (400) | — | 134 при 10 А г −1 |
| LiFePO 4 [ 64 ] | Zn | 2 моль л −1 ZnSO 4 + 1 моль л −1 LiCl в гидрогеле PAAm | −20 | 104 при 0,1 А г −1 | 98% (106) | 98% (500) по адресу 0.5 А г −1 | 81 при 0,5 А г −1 |
| LiFePO 4 [ 70 ] | Zn | 3 моль л -1 LiCl + 4 моль л -1 ZnCl 2 | -10 | 92,7 при 0,6 ° C | 66,7% (139) | 97% (50) | — |
| FeHCF [ 71 ] | Zn | 1 м ZnTFSI + 21 м LiTFSI в ПАМ гидрогель | −15 | 39 при 1 A г −1 | 50% (78) | 98% (100) | — |
| Bi 2 S 3 [ 72 ] | Zn | 1 м ZnTFSI + 21 м LiTFSI в ПАМ гидрогель | 0 | 100 на 0.3 A г −1 | 41,7% (240) | — | 50 при 6 A г −1 |
В 3 О 7 · В 2 О при V 2 O 5 · n H 2 O [ 17 ] | Zn | 21 м LiTFSI + 1 м Zn (CF 3 SO 3 ) 2 | −15 | 60 при 0,5 A г −1 | 27.9% (215) | — | — |
| Щелочные батареи | |||||||
| [OH) 73 ] | PAQS | 10 м KOH | −25 | 185 при 0,5 ° C | 92,5% (200) | — | 160 при 10 ° C |
| Гидроксид NiCo [ 74 ] | Zn | 6 м КОН + 0.2 м Zn (CH 3 COO) 2 в гидрогеле PANa | −20 | 126 при 9C | 86% (133) при 27C | 87% (10 000) при 19 ° C | 100 при 36 ° C |
5. Резюме и прогноз
Достойные характеристики при отрицательных температурах необходимы для практического применения батарей, в частности, проблема для ARMB из-за природы замораживания воды. Хотя исследования характеристик при отрицательных температурах все еще находятся в начальной стадии, мы отметили, что появляется все больше и больше исследований с появлением ARMB.Мы обобщили стратегии и механизмы, принятые для улучшения характеристик ARMB при отрицательных температурах, с акцентом на поведение воды при замерзании. Здесь мы хотели бы выделить следующие проблемы:
В целом, характеристики ARMB при отрицательных температурах все еще уступают их аналогам с органическим электролитом из-за того, что температура замерзания воды выше, чем у большинства органических материалов. Это может быть отражено в достижении самой низкой температуры и сохранении емкости при той же температуре.
В исследованиях улучшения электролита всегда используются органические материалы, включая добавки, гидрогель или специальные соли. Хотя это не является неприемлемым, чтобы сохранить конкурентоспособность ARMB, больше внимания следует уделять поддержанию их искробезопасности и низкой стоимости, не жертвуя принятыми органическими материалами.
Большинство исследований по улучшению характеристик ARMB при отрицательных температурах сосредоточено на модификации электролита. Хотя модификация электролита эффективна, следует отметить, что ухудшение состояния электролита также невозможно избежать при низкой температуре.С другой стороны, электроды и неактивные материалы также связаны с характеристиками ARMB при отрицательных температурах, поскольку они обеспечивают каналы транспортировки для ионов и электронов. В отличие от неизбежного ухудшения характеристик электролита, некоторые электродные материалы могут демонстрировать даже лучшую проводимость при низких температурах, что может предоставить уникальную возможность для ARMB, работающих при отрицательных температурах.
В последние годы исследования воды и гидрогеля достигли значительного прогресса.Извлечение идей из этих исследований может предоставить уникальные возможности для изучения ARMB, работающих при отрицательных температурах.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было поддержано схемой GRF в рамках проекта CityU11305218. Эта работа также частично спонсировалась Комитетом по науке, технологиям и инновациям муниципалитета Шэньчжэня (грант № JCYJ20170818103435068).
Биографии
•
Ювэй Чжао в настоящее время является доктором наук.Кандидат наук в Школе материаловедения и инженерии Городского университета Гонконга под руководством профессора Чуньи Чжи. Она получила свой M.S. и Б.С. степени в области материаловедения и инженерии Северо-Западного политехнического университета и Хайнаньского университета соответственно. Ее исследования в основном сосредоточены на гибких водных металло-ионных батареях и их низкотемпературных механизмах.
•
Чуньи Чжи в настоящее время является профессором факультета материаловедения и инженерии Городского университета Гонконга.Он получил докторскую степень. степень доктора физики Института физики Китайской академии наук. Затем он перешел в Национальный институт материаловедения (NIMS) в Японии в качестве постдокторанта, а затем научным сотрудником (преподавательский состав) и старшим научным сотрудником (постоянный). Его исследования сосредоточены на носимых / гибких устройствах хранения энергии и батареях с водным электролитом.
Банкноты
Чжао Ю., Чен З., Мо Ф., Ван Д., Го Ю., Лю З., Ли X., Ли К., Лян Г., Чжи К., Водные аккумуляторные металло-ионные батареи, работающие при отрицательных температурах .Adv. Sci. 2021, 8, 2002590 10.1002 / advs.202002590 [CrossRef] [Google Scholar]
Ссылки
2. a) Zhang S. S., Xu K., Jow T. R., J. Power Sources 2003, 115, 137; [Google Scholar] b) Jaguemont J., Boulon L., Dubé Y., Appl. Энергия 2016, 164, 99; [Google Scholar] c) Гуденаф Дж. Б., J. Solid State Electrochem. 2012, 16, 2019. [Google Scholar] 3. Ян З., Чжан Дж., Кинтнер-Мейер М. К., Лу Х., Чой Д., Леммон Дж. П., Лю Дж., Chem. Ред. 2011, 111, 3577. [PubMed] [Google Scholar] 4. Ли Х., Ма Л., Хань К., Ван З., Лю З., Тан З., Чжи К., Nano Energy 2019, 62, 550. [Google Scholar] 5. а) Хуан Дж., Го З., Ма Ю., Бинь Д., Ван Ю., Ся Ю., Малые методы 2019, 3, 1800272; [Google Scholar] б) Ким Х., Хонг Дж., Пак К. Ю., Ким Х., Ким С. В., Кан К., Chem. Ред. 2014, 114, 11788; [PubMed] [Google Scholar] c) Лю Ц., Хуан Ю., Хуанг Ю., Ян Ц., Ли X., Хуан Ц., Чжи К., Chem. Soc. Ред. 2020, 49, 180; [PubMed] [Google Scholar] г) Ван Д., Чжао Ю., Лян Г., Мо Ф., Ли Х., Хуан З., Ли Х., Тан Т., Донг Б., Чжи К., Nano Energy 2020, 71, 104583. [Google Scholar] 6. а) Чжу Г., Вэнь К., Львов В., Чжоу X., Лян Ю., Ян Ф., Чен З., Цзоу М., Ли Дж., Чжан Ю., Хэ В., Дж. Источники энергии 2015, 300, 29; [Google Scholar] б) Нянь К., Ван Дж., Лю С., Сунь Т., Чжэн С., Чжан Ю., Тао З., Чен Дж., Angew. Chem., Int. Эд. 2019, 58, 16994. [PubMed] [Google Scholar] 7. а) Sun C. Q., Zhang X., Fu X., Zheng W., Kuo J. L., Zhou Y., Shen Z., Zhou J., J. Phys. Chem. Lett. 2013, 4, 3238; [PubMed] [Google Scholar] б) Ма Л., Chen S., Li N., Liu Z., Tang Z., Zapien J., Chen S., Fan J., Zhi C., Adv. Матер. 2020, 32, 11. [PubMed] [Google Scholar] 8. Дашнау Дж. Л., Нуччи Н. В., Шарп К. А., Вандеркой Дж. М., J. Phys. Chem. B 2006, 110, 13670. [PubMed] [Google Scholar] 10. Рамануджапурам А., Юшин Г., Adv. Energy Mater. 2018, 8, 1802624. [Google Scholar] 11. Дин М.С., Кресче А., Сюй К., J. Phys. Chem. C 2017, 121, 2149. [Google Scholar] 12. Чжан С. С., Сюй К., Джоу Т. Р., Electrochem. Commun. 2002, 4, 928. [Google Scholar] 13.Парк Дж. Х., Алуру Н. Р., Мол. Simul. 2009, 35, 31. [Google Scholar] 14. Чаккараварти К., Вахид А. К. А., Удупа Х. В. К., Дж. Источники энергии 1981, 6, 203. [Google Scholar] 15. Суо Л. М., Бородин О., Гао Т., Ольгин М., Хо Дж., Фан Х. Л., Луо К., Ван С. С., Сю К., Science 2015, 350, 938. [PubMed] [Google Scholar] 16. Ван Х., Чжан Х., Ченг Й., Фэн К., Ли Х., Чжан Х., Electrochim. Acta 2018, 278, 279. [Google Scholar] 17. Ли X., Ma L., Zhao Y., Yang Q., Wang D., Huang Z., Liang G., Mo F., Liu Z., Чжи К., Матер. Сегодня Энергия 2019, 14, 100361. [Google Scholar] 18. Цзян Л., Лу Й., Чжао К., Лю Л., Чжан Дж., Чжан К., Шен Х., Чжао Дж., Ю Х., Ли Х., Хуан Х., Чен Л., Ху Ю. . ‐ S., Nat. Энергия 2019, 4, 495. [Google Scholar] 19. Becker M., Kuehnel R. S., Battaglia C., Chem. Commun. 2019, 55, 12032. [PubMed] [Google Scholar] 20. Ребер Д., Кюнель Р. С., Батталья К., ACS Mater. Lett. 2019, 1, 44. [Google Scholar] 21. а) Ван Ф., Линь Ю., Суо Л., Фань Х., Гао Т., Ян К., Хань Ф., Ци Ю., Сюй К., Ван К., Energy Environ. Sci. 2016, 9, 3666; [Google Scholar] б) Чжао К., Захман М. Дж., Садат В. А., Чжэн Дж., Куркутис Л. Ф., Арчер Л., Sci. Adv. 2018, 4, eaau8131. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Чен К., Ю З., Дэн С., Ву К., Цзоу Дж., Цзэн Х., Дж. Источники энергии 2015, 278, 411. [Google Scholar] 23. а) Ямада Ю., Бюл. Chem. Soc. Jpn. 2020, 93, 109; [Google Scholar] b) Суо Л., Бородин О., Сун В., Фан Х., Ян К., Ван Ф., Гао Т., Ма З., Шредер М., фон Кресче А., Рассел С. М., Арман М., Энджелл А., Сюй К., Ван К., Энджью. Chem., Int. Эд. 2016, 55, 7136; [PubMed] [Google Scholar] c) Сонг М., Тан Х., Чао Д., Фан Х. Дж., Adv. Функц. Матер. 2018, 28, 1802564. [Google Scholar] 24. а) Бородин О., Селф Дж., Перссон К. А., Ван К., Сю К., Джоуль 2020, 4, 69; [Google Scholar] b) Йошида К., Накамура М., Казуэ Ю., Тачикава Н., Цузуки С., Секи С., Докко К., Ватанабэ М., Дж. Ам. Chem. Soc. 2011, 133, 13121; [PubMed] [Google Scholar] c) Ван Х., Лю Р., Ли Ю., Лю X., Ван К., Чжао С., Юань К., Цуй З., Ли Х., Синь С., Чжан Р., Лей М., Линь З., Джоуль 2018, 2, 337. [Google Scholar] 25. Yamada Y., Yaegashi M., Abe T., Yamada A., Chem. Commun. 2013, 49, 11194. [PubMed] [Google Scholar] 26. Суо Л., Ху Ю. С., Ли Х., Арманд М., Чен Л., Nat. Commun. 2013, 4, 1481. [PubMed] [Google Scholar] 27. а) Ван Дж., Ямада Ю., Содеяма К., Ватанабэ Э., Такада К., Татэяма Ю., Ямада А., Nat. Энергия 2018, 3, 22. [Google Scholar] 28. а) Суо Л., О Д., Линь Ю., Чжо З., Бородин О., Гао Т., Ван Ф., Кусима А., Ван З., Kim H. C., Qi Y., Yang W., Pan F., Li J., Xu K., Wang C., J. Am. Chem. Soc. 2017, 139, 18670; [PubMed] [Google Scholar] б) Ян К., Чен Дж., Цин Т., Фан Х., Сун В., Кресче А., Дин М.С., Бородин О., Ватаману Дж., Шредер М.А., Эйдсон Н. , Ван К., Сюй К., Джоуль 2017, 1, 122. [Google Scholar] 29. а) Яаков Д., Гофер Ю., Аурбах Д., Халалай И. С., J. Electrochem. Soc. 2010, 157, А1383; [Google Scholar] б) Го Ю., Лю Дж., Ян К., Ма Л., Чжао Ю., Хуан З., Ли Х., Дун Б., Фу Х., Чжи К., Смолл 2020, 16, 11.[Google Scholar]30. Wang F., Borodin O., Ding M. S., Gobet M., Vatamanu J., Fan X., Gao T., Eidson N., Liang Y., Sun W., Greenbaum S., Xu K., Wang C., Joule 2018, 2, 927. [Google Scholar]31. a) Liao L., Fang T., Zhou X., Gao Y., Cheng X., Zhang L., Yin G., Solid State Ionics 2014, 254, 27; [Google Scholar]b) Liao L., Cheng X., Ma Y., Zuo P., Fang W., Yin G., Gao Y., Electrochim. Acta 2013, 87, 466. [Google Scholar]32. Haregewoin A. M., Wotango A. S., Hwang B.‐J., Energy Environ. Sci. 2016, 9, 1955.[Google Scholar] 33. Доу К., Лэй С., Ван Д. В., Чжан К., Сяо Д., Го Х., Ван А., Ян Х., Ли Ю., Ши С., Ян Х., Energy Environ. Sci. 2018, 11, 3212. [Google Scholar] 34. Ямада Ю., Фурукава К., Содеяма К., Кикучи К., Яэгаши М., Татэяма Ю., Ямада А., J. Am. Chem. Soc. 2014, 136, 5039. [PubMed] [Google Scholar] 35. Wen Y. C., Kuo H. C., Guo J. L., Jia H. W., J. Phys. Chem. B 2016, 120, 13125. [PubMed] [Google Scholar] 37. Чанг Н., Ли Т., Ли Р., Ван С., Инь Ю., Чжан Х., Ли Х., Energy Environ.Sci. 2020. [Google Scholar] 38. Майнар А. Р., Леонет О., Бенгоэча М., Бояно И., де Меатза И., Кваша А., Герфи А., Бласкес Дж. А., Int. J. Energy Res. 2016, 40, 1032. [Google Scholar] 39. Сюй М., Айви Д. Г., Се З., Цюй В., Дж. Источники энергии 2015, 283, 358. [Google Scholar] 40. Rong Q., Lei W., Chen L., Yin Y., Zhou J., Liu M., Angew. Chem., Int. Эд. 2017, 56, 14159. [PubMed] [Google Scholar] 41. Han L., Liu K., Wang M., Wang K., Fang L., Chen H., Zhou J., Lu X., Adv. Функц. Матер. 2018, 28, 1704195.[Google Scholar] 42. Гао Х., Чжао З., Цай Ю., Чжоу Дж., Хуа В., Чен Л., Ван Л., Чжан Дж., Хань Д., Лю М., Цзян Л., Нат. Commun. 2017, 8, 15911. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Chen F., Zhou D., Wang J., Li T., Zhou X., Gan T., Handschuh-Wang S., Zhou X., Angew. Chem., Int. Эд. 2018, 57, 6568. [PubMed] [Google Scholar] 44. Мо Ф., Лян Г., Мэн К., Лю З., Ли Х., Фань Дж., Чжи К., Energy Environ. Sci. 2019, 12, 706. [Google Scholar] 45. а) Файтер А. Э. Р., Гибсон М. И., Дрейпер Э. Р., J. Mater. Chem. B 2018, 6, 7274; [Бесплатная статья PMC] [PubMed] [Google Scholar] б) Пан X., Ван К., Нин Д., Дай Л., Лю К., Ни Ю., Чен Л., Хуанг Л., ACS Biomater. Sci. Англ. 2018, 4, 3397. [Google Scholar] 46. Морелль X. П., Иллеперума В. Р., Тиан К., Бай Р., Суо З., Влассак Дж. Дж., Adv. Матер. 2018, 30, 1801541. [PubMed] [Google Scholar] 47. Wei J., Wei G., Shang Y., Zhou J., Wu C., Wang Q., Adv. Матер. 2020, 32, 18. [Google Scholar] 48. Пэй З., Юань З., Ван К., Чжао С., Фэй Дж., Вэй Л., Чен Дж., Wang C., Qi R., Liu Z., Chen Y., Angew. Chem., Int. Ed. 2020, 59, 4793. [PubMed] [Google Scholar]49. a) Mo F., Chen Z., Liang G., Wang D., Zhao Y., Li H., Dong B., Zhi C., Adv. Energy Mater. 2020, 10, 2000035; [Google Scholar]b) Liang G., Wang Y., Huang Z., Mo F., Li X., Yang Q., Wang D., Li H., Chen S., Zhi C., Adv. Mater. 2020, 32, 12. [PubMed] [Google Scholar]50. Mo F., Liang G., Wang D., Tang Z., Li H., Zhi C., EcoMat 2019, 1, e12008. [Google Scholar]51. Chen S., Zhang Y., Geng H., Yang Y., Rui X., Li C. C., J. Power Sources 2019, 441, 227192. [Google Scholar]52. a) Wang G. J., Qu Q. T., Wang B., Shi Y., Tian S., Wu Y. P., Holze R., J. Power Sources 2009, 189, 503; [Google Scholar]b) Tang K., Yu X., Sun J., Li H., Huang X., Electrochim. Acta 2011, 56, 4869. [Google Scholar]53. Yang Y., Tang Y., Liang S., Wu Z., Fang G., Cao X., Wang C., Lin T., Pan A., Zhou J., Nano Energy 2019, 61, 617. [Google Scholar]54. Wu X., Guo Y., Su J., Xiong J., Zhang Y., Wan L., Adv. Energy Mater. 2013, 3, 1155.[Google Scholar] 55. Nian Q., Liu S., Liu J., Zhang Q., Shi J., Liu C., Wang R., Tao Z., Chen J., ACS Appl. Energy Mater. 2019, 2, 4370. [Google Scholar] 56. а) Сапкота П., Ким Х., J. Ind. Eng. Chem. 2010, 16, 39; [Google Scholar] б) Лю Ф., Чунг Х.-Дж., Эллиотт Дж. А. У., ACS Appl. Energy Mater. 2018, 1, 1489. [Google Scholar] 57. а) Лю Ф., Заргарзаде Л., Чунг Х. Дж., Эллиотт Дж. А. У., J. Phys. Chem. B 2017, 121, 9452; [PubMed] [Google Scholar] б) Прикетт Р. К., Эллиотт Дж. А., МакГанн Л. Э., Криобиология 2010, 60, 30.[PubMed] [Google Scholar] 58. Жуй X. Х., Цзинь Й., Фэн X. Y., Чжан Л. С., Чен К. Х., Дж. Источники энергии 2011, 196, 2109. [Google Scholar] 59. Ли Дж., Ли К.-Л., Пак К., Ким И.-Д., Дж. Источники энергии 2014, 248, 1211. [Google Scholar] 60. Лю Т., Чжан М., Ван Ю. Л., Ван К. Ю., Льв К., Лю К. X., Суреш С., Инь Ю. Х., Ху Ю., Ли Ю. С., Лю X. Б., Чжун С. В., Ся Б. Ю., Ву З. П., Adv. Energy Mater. 2018, 8, 1802349. [Google Scholar] 61. Реммлингер Дж., Типпманн С., Бухгольц М., Дитмайер К., Дж. Источники энергии 2014, 254, 268.[Google Scholar] 62. Кунду Д., Ваджаргах С. Х., Ван Л., Адамс Б., Прендергаст Д., Назар Л. Ф., Energy Environ. Sci. 2018, 11, 881. [Google Scholar] 63. а) Чжан С. С., Сюй К., Джоу Т. Р., Electrochim. Acta 2004, 49, 1057; [Google Scholar] b) Waldmann T., Wilka M., Kasper M., Fleischhammer M., Wohlfahrt-Mehrens M., J. Power Sources 2014, 262, 129; [Google Scholar] c) Родригес М.-Т. Ф., Бабу Г., Гуллапалли Х., Калага К., Сайед Ф. Н., Като К., Джойнер Дж., Аджаян П. М., Nat. Энергия 2017, 2, 17108. [Google Scholar] 64.Zhu M., Wang X., Tang H., Wang J., Hao Q., Liu L., Li Y., Zhang K., Schmidt O.G., Adv. Функц. Матер. 2020, 30, 1
8. [Google Scholar] 65. Чжэн Ф., Ян К., Цзи Х., Ху Д., Чен Ю., Лю М., Дж. Источники энергии 2015, 288, 337. [Google Scholar] 66. а) Ямагата М., Мацуи Ю., Сугимото Т., Кикута М., Хигашизаки Т., Коно М., Исикава М., J. Power Sources 2013, 227, 60; [Google Scholar] б) Ху Л., Чжан З., Амин К., Electrochem. Commun. 2013, 35, 76; [Google Scholar] c) Смарт М. К., Ратнакумар Б. В., Сурампуди С., J. Electrochem. Soc. 1999, 146, 486; [Google Scholar] г) Чжан С.С., Сюй К., Джоу Т. Р., Electrochem. Commun. 2002, 4, 928; [Google Scholar] e) О С. В., Мён С. Т., О С. М., О К. Х., Амин К., Скросати Б., Сун Ю. К., Adv. Матер. 2010, 22, 4842. [PubMed] [Google Scholar] 67. Трон А., Чон С., Пак Й. Д., Мун Дж., ACS Sustainable Chem. Англ. 2019, 7, 14531. [Google Scholar] 68. Chen J., Vatamanu J., Xing L., Borodin O., Chen H., Guan X., Liu X., Xu K., Li W., Adv. Energy Mater. 2020, 10, 14.[Google Scholar] 69. Suo L., Han F., Fan X., Liu H., Xu K., Wang C., J. Mater. Chem. А 2016, 4, 6639. [Google Scholar] 70. Есиболати Н., Умиров Н., Койшыбай А., Омарова М., Курманбаева И., Чжан Ю., Чжао Ю., Бакенов З., Электрохимия. Acta 2015, 152, 505. [Google Scholar] 71. Ян К., Мо Ф., Лю З., Ма Л., Ли Х., Фанг Д., Чен С., Чжан С., Чжи К., Adv. Матер. 2019, 31, 11. [PubMed] [Google Scholar] 72. Чжао Ю., Ма Л., Чжу Ю., Цинь П., Ли Х., Мо Ф., Ван Д., Лян Г., Ян К., Лю В., Чжи К., САУ Нано 2019, 13, 7270. [PubMed] [Google Scholar] 73. Лян Ю., Цзин Ю., Гейтани С., Ли К. Ю., Лю П., Факкетти А., Яо Ю., Нат. Матер. 2017, 16, 841. [PubMed] [Google Scholar] 74. Ван Х., Лю Дж., Ван Дж., Ху М., Фэн Й., Ван П., Ван Й., Не Н., Чжан Дж., Чен Х., Юань К., Ву Дж., Хуан Ю. ., ACS Appl. Матер. Интерфейсы 2019, 11, 49. [PubMed] [Google Scholar] Свинцово-кислотные батареи| PVEducation
5 свинцово-кислотных аккумуляторов
Свинцово-кислотные батареи — наиболее часто используемый тип батарей в фотоэлектрических системах.Хотя свинцово-кислотные батареи имеют низкую плотность энергии, умеренный КПД и высокие требования к техническому обслуживанию, они также имеют длительный срок службы и низкие затраты по сравнению с другими типами батарей. Одним из исключительных преимуществ свинцово-кислотных аккумуляторов является то, что они являются наиболее часто используемой формой аккумуляторов для большинства аккумуляторных батарей (например, для запуска двигателей автомобилей) и, следовательно, имеют хорошо зарекомендовавшую себя зрелую технологическую базу.
Рисунок: Изменение напряжения в зависимости от степени заряда для нескольких различных типов батарей.
Свинцово-кислотная батарея состоит из отрицательного электрода из губчатого или пористого свинца. Свинец пористый, что способствует образованию и растворению свинца. Положительный электрод состоит из оксида свинца. Оба электрода погружены в электролитический раствор серной кислоты и воды. В случае, если электроды входят в контакт друг с другом в результате физического движения батареи или изменения толщины электродов, два электрода разделяет электрически изолирующая, но химически проницаемая мембрана.Эта мембрана также предотвращает короткое замыкание через электролит. Свинцово-кислотные батареи накапливают энергию за счет обратимой химической реакции, показанной ниже.
Общая химическая реакция:
PbO2 + Pb + 2h3SO4⇔заряженный разряд2PbSO4 + 2h3O
На минусовой клемме реакции заряда и разряда:
Pb + SO42-зарядкаPbSO4 + 2e-
На положительном выводе реакции заряда и разряда:
PbO2 + SO42- + 4H ++ 2e-Заряженный разрядPbSO4 + 2h3O
Как показывают приведенные выше уравнения, разрядка батареи вызывает образование кристаллов сульфата свинца как на отрицательной, так и на положительной клеммах, а также высвобождение электронов из-за изменения валентного заряда свинца.Для образования этого сульфата свинца используется сульфат сернокислотного электролита, окружающего аккумулятор. В результате электролит становится менее концентрированным. Полный разряд приведет к тому, что оба электрода будут покрыты сульфатом свинца и водой, а не серной кислотой, окружающей электроды. При полном разряде два электрода сделаны из одного материала, и между двумя электродами отсутствует химический потенциал или напряжение. На практике, однако, разряд прекращается при напряжении отсечки, задолго до этого момента.Поэтому аккумулятор не должен разряжаться ниже этого напряжения.
Между полностью разряженным и заряженным состояниями свинцово-кислотная батарея будет испытывать постепенное снижение напряжения. Уровень напряжения обычно используется для обозначения степени заряда аккумулятора. Зависимость аккумулятора от уровня заряда показана на рисунке ниже. Если аккумулятор оставить на низком уровне заряда в течение длительного периода времени, могут вырасти крупные кристаллы сульфата свинца, что необратимо снижает емкость аккумулятора.Эти более крупные кристаллы не похожи на типичную пористую структуру свинцового электрода, и их трудно превратить обратно в свинец.
В результате реакции зарядки сульфат свинца на отрицательном электроде превращается в свинец. На положительном конце реакция превращает свинец в оксид свинца. В качестве побочного продукта этой реакции выделяется водород. Во время первой части цикла зарядки преобладающей реакцией является превращение сульфата свинца в свинец и оксид свинца. Однако по мере того, как происходит зарядка и большая часть сульфата свинца превращается либо в свинец, либо в диоксид свинца, зарядный ток электролизует воду из электролита, и выделяются водород и газообразный кислород, процесс, известный как «выделение газа» из батареи.Если ток подается в батарею быстрее, чем может быть преобразован сульфат свинца, то выделение газа начинается до того, как весь сульфат свинца будет преобразован, то есть до того, как батарея будет полностью заряжена. Газообразование создает несколько проблем в свинцово-кислотной батарее. Газообразование батареи не только вызывает проблемы безопасности из-за взрывоопасной природы производимого водорода, но также уменьшает количество воды в батарее, которую необходимо заменять вручную, вводя в систему компонент для обслуживания.Кроме того, выделение газа может вызвать выделение активного материала из электролита, что приведет к необратимому снижению емкости аккумулятора. По этим причинам аккумулятор не следует регулярно заряжать выше напряжения, которое вызывает газообразование. Напряжение газовыделения изменяется в зависимости от скорости заряда.
Сульфат свинца является изолятором, и поэтому способ образования сульфата свинца на электродах определяет, насколько легко можно разрядить аккумулятор.
Для большинства систем возобновляемой энергии наиболее важными характеристиками батареи являются срок службы батареи, глубина разряда и требования к обслуживанию батареи.Этот набор параметров и их взаимосвязь с режимами зарядки, температурой и возрастом описаны ниже.
Глубина разряда в сочетании с емкостью батареи является фундаментальным параметром в конструкции блока батарей для фотоэлектрической системы, поскольку энергия, которая может быть извлечена из батареи, определяется умножением емкости батареи на глубину разряда. Батареи классифицируются как батареи глубокого или мелкого цикла. Глубина разряда батареи глубокого цикла может превышать 50%, а может достигать 80%.Чтобы достичь такой же полезной емкости, аккумуляторная батарея мелкого цикла должна иметь большую емкость, чем аккумуляторная батарея глубокого цикла.
Помимо глубины разряда и номинальной емкости аккумулятора, мгновенная или доступная емкость аккумулятора сильно зависит от скорости разряда аккумулятора и рабочей температуры аккумулятора. Емкость аккумулятора падает примерно на 1% на градус ниже примерно 20 ° C. Однако высокие температуры также не идеальны для аккумуляторов, поскольку они ускоряют старение, саморазряд и расход электролита.На приведенном ниже графике показано влияние температуры и скорости разряда аккумулятора на емкость аккумулятора.
Рисунок: Взаимосвязь между емкостью батареи, температурой и скоростью разряда.
Со временем емкость аккумулятора снижается из-за сульфатирования аккумулятора и выделения активного материала. Ухудшение емкости аккумулятора наиболее сильно зависит от взаимосвязи следующих параметров:
- режим зарядки / разрядки аккумулятора
- DOD батареи в течение срока ее службы
- его воздействие на длительные периоды низкого разряда
- средняя температура батареи за весь срок службы
На следующем графике показано изменение функции аккумулятора в зависимости от количества циклов и глубины разряда для свинцово-кислотных аккумуляторов с поверхностным циклом.Свинцово-кислотная батарея глубокого разряда должна иметь срок службы более 1000 циклов даже при глубине разряда более 50%.
Рисунок: Взаимосвязь между емкостью батареи, глубиной разряда и сроком службы для батареи с малым циклом разряда.
Помимо DOD, режим зарядки также играет важную роль в определении срока службы батареи. Перезаряд или недозаряд батареи приводит либо к потере активного материала, либо к сульфатированию батареи, что значительно сокращает срок ее службы.
Рисунок: Влияние режима зарядки на емкость аккумулятора.
Окончательное влияние на зарядку аккумулятора связано с температурой аккумулятора. Хотя емкость свинцово-кислотной батареи снижается при работе при низких температурах, работа при высоких температурах увеличивает скорость старения батареи.
Рисунок: Взаимосвязь между емкостью батареи, температурой и сроком службы батареи глубокого цикла.
Кривые разряда при постоянном токе для свинцово-кислотной батареи емкостью 550 Ач при различных скоростях разряда с ограничивающим напряжением 1.85 В на ячейку (Mack, 1979). Более длительное время разряда увеличивает емкость аккумулятора.
Производство водорода и кислорода из аккумуляторной батареи приводит к потере воды, поэтому в свинцово-кислотных аккумуляторных батареях необходимо регулярно заменять воду. Другие компоненты аккумуляторной системы не требуют регулярного обслуживания, поэтому потеря воды может стать серьезной проблемой. Если система находится в удаленном месте, проверка потери воды может увеличить затраты. Необслуживаемые батареи ограничивают потребность в регулярном внимании, предотвращая или уменьшая количество газа, выходящего из батареи.Однако из-за коррозионной природы электролита все батареи в некоторой степени вводят дополнительный компонент для обслуживания фотоэлектрической системы.
Свинцово-кислотные батареи обычно имеют кулоновский КПД 85% и КПД по энергии порядка 70%.
В зависимости от того, какая из вышеперечисленных проблем является наиболее важной для конкретного приложения, соответствующие модификации базовой конфигурации батареи улучшают ее характеристики. В случае использования возобновляемых источников энергии указанные выше проблемы повлияют на глубину разряда, срок службы батареи и требования к техническому обслуживанию.Изменения в батарее обычно включают модификацию в одной из трех основных областей:
- изменения состава и геометрии электродов
- изменения в раствор электролита
- модификации корпуса или клемм аккумуляторной батареи для предотвращения или уменьшения утечки образующегося газообразного водорода.
Залитые свинцово-кислотные батареи характеризуются длительным циклом работы и длительным сроком службы. Однако залитые батареи требуют периодического обслуживания. Необходимо не только регулярно контролировать уровень воды в электролите, измеряя его удельный вес, но эти батареи также требуют «ускоренной зарядки».
Ускоренная зарядка
Ускоренная или выравнивающая зарядка включает в себя кратковременную периодическую перезарядку, при которой выделяется газ и смешивается электролит, что предотвращает расслоение электролита в батарее. Кроме того, ускоренная зарядка помогает поддерживать одинаковую емкость всех аккумуляторов. Например, если одна батарея развивает более высокое внутреннее последовательное сопротивление, чем другие батареи, тогда батарея с более низким SR будет постоянно недозаряжаться во время нормального режима зарядки из-за падения напряжения на последовательном сопротивлении.Однако, если батареи заряжаются более высоким напряжением, это позволяет полностью зарядить все батареи.
Удельный вес (SG)
В затопленной аккумуляторной батарее происходит потеря воды из электролита из-за выделения водорода и кислорода. Удельный вес электролита, который можно измерить ареометром, укажет на необходимость добавления воды в батареи, если батареи полностью заряжены. В качестве альтернативы ареометр точно покажет SOC батареи, если известно, что уровень воды правильный.SG периодически измеряется после ускоренной зарядки, чтобы убедиться, что в батарее достаточно воды в электролите. SG батареи должен быть предоставлен производителем.
Особые требования к гелевым герметичным свинцово-кислотным аккумуляторам
Свинцово-кислотные батареив гелеобразном состоянии или AGM (которые обычно герметичны или регулируются с помощью клапана) имеют несколько потенциальных преимуществ:
- их можно использовать для глубокого цикла с сохранением срока службы батареи
- они не нуждаются в ускоренной зарядке
- они требуют меньшего обслуживания.
Однако эти батареи обычно требуют более точного режима зарядки и более низкого напряжения. Режим зарядки с более низким напряжением обусловлен использованием свинцово-кальциевых электродов для минимизации выделения газов, но требуется более точный режим зарядки, чтобы минимизировать выделение газов от батареи. Кроме того, эти батареи могут быть более чувствительными к колебаниям температуры, особенно если режим зарядки не компенсирует температуру или не предназначен для этих типов батарей.
Аккумулятор для фотоэлектрической системы будет рассчитан на определенное количество циклов при определенном DOD, режиме зарядки и температуре.Однако батареи могут преждевременно терять емкость или внезапно выходить из строя по разным причинам. Внезапный отказ может быть вызван внутренним коротким замыканием батареи из-за отказа электрического разделителя внутри батареи. Короткое замыкание в батарее снизит напряжение и емкость всего блока батарей, особенно если секции батареи подключены параллельно, а также приведет к другим потенциальным проблемам, таким как перезаряд оставшихся батарей.Батарея также может выйти из строя из-за разрыва цепи (то есть может происходить постепенное увеличение внутреннего последовательного сопротивления), и любые батареи, подключенные последовательно с этой батареей, также будут затронуты. Замораживание аккумулятора, в зависимости от типа используемого свинцово-кислотного аккумулятора, также может вызвать необратимый выход аккумулятора из строя.
Постепенное снижение емкости может усугубляться неправильной работой, в частности, ухудшением DOD. Однако работа одной части блока батарей в условиях, отличных от другой, также приведет к снижению общей емкости и увеличению вероятности отказа батареи.Батареи могут непреднамеренно эксплуатироваться в разных режимах либо из-за колебаний температуры, либо из-за отказа батареи в одной цепочке батарей, что приводит к неравномерной зарядке и разрядке в цепочке.
Установка
Батареи устанавливаются в соответствии с действующим стандартом страны, в которой они устанавливаются. В настоящее время существуют австралийские стандарты AS3011 и AS2676 для установки батарей. Существует также проект стандарта для аккумуляторов для приложений RAPS, который в конечном итоге станет австралийским стандартом.
Среди других факторов, которые необходимо учитывать при установке аккумуляторной системы, являются вентиляция, необходимая для конкретного типа аккумуляторной батареи, условия заземления, на которых должна быть размещена аккумуляторная батарея, и меры, принятые для обеспечения безопасности тех, кто может иметь доступ к аккумуляторной батарее. Кроме того, при установке блока батарей необходимо следить за тем, чтобы температура батареи находилась в пределах допустимых условий эксплуатации батареи и чтобы температура батарей в большем блоке батарей была такой же.Батареи в очень холодных условиях могут замерзнуть при низком уровне заряда, поэтому зимой вероятность того, что батарея будет разряжена, будет ниже. Чтобы предотвратить это, аккумуляторную батарею можно закопать под землю. Аккумуляторы, регулярно подвергающиеся воздействию высоких рабочих температур, также могут иметь сокращенный срок службы.
Батареи потенциально опасны, и пользователи должны знать о трех основных опасностях: Серная кислота в электролите вызывает коррозию. При работе с аккумуляторами необходима не только защита ног и глаз, но и защитная одежда.
Батареи обладают способностью генерировать большой ток. Если металлический предмет случайно попадает на клеммы батареи, через этот предмет могут протекать большие токи. При работе с батареями следует минимизировать присутствие ненужных металлических предметов (например, украшений), а инструменты должны иметь изолированные ручки.
Опасность взрыва из-за выделения газообразного водорода и кислорода. Во время зарядки, особенно при перезарядке, некоторые батареи, включая большинство батарей, используемых в фотоэлектрических системах, могут выделять потенциально взрывоопасную смесь водорода и кислорода.Чтобы снизить риск взрыва, используется вентиляция для предотвращения скопления этих газов, а потенциальные источники воспламенения (т. Е. Цепи, которые могут генерировать искры или дуги) исключаются из корпуса аккумуляторной батареи.
Аккумуляторы вводят компонент периодического обслуживания в фотоэлектрическую систему. Для всех аккумуляторов, включая «необслуживаемые», требуется график технического обслуживания, который должен обеспечивать:
- клеммы АКБ не корродированы
- соединения аккумулятора затянуты
- корпус аккумуляторной батареи не должен иметь трещин и коррозии.
Залитые батареи требуют дополнительного и более частого обслуживания. В случае залитых батарей уровень электролита и удельный вес электролита для каждой батареи необходимо регулярно проверять. Проверку удельного веса аккумулятора с помощью ареометра следует проводить не менее чем через 15 минут после выравнивания или ускоренного заряда. В аккумуляторы следует добавлять только дистиллированную воду. Водопроводная вода содержит минералы, которые могут повредить электроды батареи.
Свинец в свинцово-кислотной батарее представляет опасность для окружающей среды при неправильной утилизации.Свинцово-кислотные батареи следует утилизировать, чтобы можно было восстановить свинец без ущерба для окружающей среды.
Материалы, из которых изготовлены электроды, сильно влияют на химический состав батареи и, следовательно, влияют на напряжение батареи и ее характеристики зарядки и разрядки. Геометрия электрода определяет внутреннее последовательное сопротивление, а также скорость заряда и разряда.
Основными материалами анода и катода в свинцово-кислотной батарее являются свинец и диксоди свинец (PbO2).Свинцовый электрод выполнен в виде губчатого свинца. Губчатый свинец желателен, поскольку он очень пористый, и поэтому площадь поверхности между свинцом и электролитом серной кислоты очень велика. Добавление небольших количеств других элементов в свинцовый электрод для образования сплавов свинца может уменьшить некоторые недостатки, связанные со свинцом. Основными типами используемых электродов являются свинец / сурьма (с использованием нескольких процентов сурьмы), сплавы свинец / кальций и сплавы свинец / сурьма / кальций.
Аккумуляторы из свинцового сплава с сурьмой имеют несколько преимуществ перед электродами из чистого свинца.К этим преимуществам относятся: более низкая стоимость свинца / сурьмы; повышенная прочность свинцово-сурьмянистого электрода; и возможность получить глубокую разрядку на короткий период времени. Однако сплавы свинец / сурьма склонны к сульфатированию, и их не следует оставлять при низком уровне заряда в течение длительных периодов времени. Кроме того, сплавы свинец / сурьма увеличивают выделение газа из аккумулятора во время зарядки, что приводит к значительным потерям воды. Поскольку в эти батареи необходимо добавлять воду, они требуют более серьезного обслуживания.Кроме того, свинцово-сурьмяные батареи отличаются высокой скоростью разряда и коротким сроком службы. Эти проблемы (xx — проверьте, вызваны ли обе проблемы металлизацией)) вызваны растворением сурьмы с одного электрода и ее осаждением или осаждением на другом электроде. (xx повышенная адгезия PbO2 xx)
Свинцово-кальциевые батареи — это технология со средней стоимостью. Как и сурьма, кальций также добавляет прочности свинцу отрицательного электрода, но, в отличие от сурьмы, добавление кальция снижает выделение газа в батарее, а также снижает скорость саморазряда.Однако свинцово-кальциевые батареи не следует сильно разряжать. Следовательно, эти типы батарей могут считаться «необслуживаемыми», но это только батареи с малым циклом разряда.
Добавление сурьмы, а также кальция в электроды дает некоторые преимущества как сурьмы, так и свинца, но при более высокой стоимости. Батареи глубокого разряда, подобные этим, также могут иметь длительный срок службы. Кроме того, к электродам могут быть добавлены следовые количества других материалов для повышения производительности батареи.
Помимо материала, из которого изготовлены электродные пластины, физическая конфигурация электродов также влияет на скорость заряда и разряда и на срок службы. Тонкие пластины обеспечивают более быструю зарядку и разрядку, но они менее прочные и более склонны к отслаиванию материала с пластин. Поскольку высокие токи зарядки или разрядки обычно не являются обязательной характеристикой аккумуляторов для систем возобновляемой энергии, можно использовать более толстые пластины, которые имеют меньшее время зарядки и разрядки, но также имеют более длительный срок службы.
В открытой залитой батарее любой образующийся газ может улетучиваться в атмосферу, вызывая проблемы как безопасности, так и обслуживания. Герметичный свинцово-кислотный (SLA), свинцово-кислотный (VRLA) с регулируемым клапаном или рекомбинированный свинцово-кислотный аккумулятор предотвращает потерю воды из электролита, предотвращая или сводя к минимуму утечку газообразного водорода из аккумулятора. В герметичной свинцово-кислотной батарее (SLA) водород не улетучивается в атмосферу, а скорее перемещается или мигрирует к другому электроду, где он рекомбинирует (возможно, с помощью процесса каталитического преобразования) с образованием воды.Эти батареи не являются полностью герметичными, а имеют вентиляционное отверстие для предотвращения создания избыточного давления в батарее. Герметичные батареи требуют строгого контроля заряда, чтобы предотвратить накопление водорода быстрее, чем он может рекомбинировать, но они требуют меньше обслуживания, чем открытые батареи.
Свинцово-кислотные батареи с регулируемым клапаном (VRLA) аналогичны по концепции герметичным свинцово-кислотным (SLA) аккумуляторным батареям, за исключением того, что клапаны должны выделять водород почти полностью.Аккумуляторы SLA или VRLA обычно имеют дополнительные конструктивные особенности, такие как использование гелеобразных электролитов и использование свинцово-кальциевых пластин для сведения к минимуму выделения газообразного водорода.
Несмотря на разнообразие типов аккумуляторов и областей применения, особенно важными характеристиками фотоэлектрических систем являются требования к обслуживанию аккумулятора и способность глубоко заряжать аккумулятор при сохранении длительного срока службы. Для обеспечения длительного срока службы при глубоком разряде батареи глубокого разряда могут быть либо открытого типа, с избытком электролитического раствора и толстыми пластинами, либо иммобилизованного электролитического типа.Герметичные гелевые батареи могут быть классифицированы как батареи глубокого разряда, но они обычно выдерживают меньшее количество циклов и меньшие разряды, чем специально разработанные батареи с заливной пластиной или батареи AGM. В аккумуляторах с мелким циклом обычно используются более тонкие пластины, изготовленные из свинцово-кальциевых сплавов, и обычно глубина разряда не превышает 25%.
Батареи для фотоэлектрических или удаленных источников питания (RAPS)
Строгие требования к батареям, используемым в фотоэлектрических системах, побудили нескольких производителей изготавливать батареи, специально разработанные для фотоэлектрических или других удаленных систем питания.В автономных фотоэлектрических системах чаще всего используются батареи свинцово-кислотного типа с глубоким циклом или необслуживаемые батареи с меньшим циклом. Батареи глубокого цикла могут быть батареями с открытым заливом (которые не требуют обслуживания) или батареями AGM с невыпадающим электролитом, которые не требуют обслуживания (но которые требуют осторожности при выборе регулятора). Специальные необслуживаемые батареи с малым циклом работы, которые выдерживают нечастую разрядку, также могут использоваться в фотоэлектрических системах, и при условии, что аккумуляторная батарея спроектирована надлежащим образом, никогда не требуется DOD более 25%.Аккумулятор с длительным сроком службы в правильно спроектированной фотоэлектрической системе при правильном обслуживании может прослужить до 15 лет, но использование батарей, которые не предназначены для длительного срока службы, или условий в фотоэлектрической системе, или являются частью плохой конструкции системы может привести к выходу из строя аккумуляторного блока всего через несколько лет.
Доступны несколько других типов батарей специального назначения, они описаны ниже.
Пусковые, осветительные батареи зажигания (SLI). Эти аккумуляторы используются в автомобилях и отличаются высокой скоростью разряда и заряда.Чаще всего используются электродные пластины, упрочненные либо свинцово-сурьмяной в залитой конфигурации, либо свинцово-кальциевой в герметичной конфигурации. Эти батареи имеют хороший срок службы в условиях малого цикла, но имеют очень низкий срок службы в условиях глубокого цикла. Батареи SLI не следует использовать в фотоэлектрической системе, поскольку их характеристики не оптимизированы для использования в системе возобновляемых источников энергии, поскольку срок службы фотоэлектрической системы очень мал.
Тяговые или тяговые аккумуляторные батареи. Тяговые или двигательные батареи используются для обеспечения электроэнергией небольших транспортных средств, таких как гольф-кары.По сравнению с батареями SLI, они обладают большей способностью выдерживать глубокий цикл при сохранении длительного срока службы. Хотя эта особенность делает их более подходящими для фотоэлектрической системы, чем та, в которой используются батареи SLI, двигательные батареи не должны использоваться в каких-либо фотоэлектрических системах, поскольку их скорость саморазряда очень высока из-за использования свинцово-сурьмяных электродов. Высокая скорость саморазряда фактически приведет к большим потерям мощности в батарее и сделает общую фотоэлектрическую систему неэффективной, если батареи не будут испытывать большой DOD на ежедневной основе.Способность этих аккумуляторов выдерживать глубокие циклы также намного ниже, чем у настоящих аккумуляторов глубокого цикла. Поэтому эти батареи не подходят для фотоэлектрических систем.
Жилые или морские батареи. Эти батареи обычно представляют собой компромисс между батареями SLI, тяговыми батареями и настоящими батареями глубокого цикла. Хотя они и не рекомендуются, в некоторых небольших фотоэлектрических системах используются двигательные и морские батареи. Срок службы таких батарей будет ограничен в лучшем случае несколькими годами, так что экономия на замене батарей означает, что такие батареи, как правило, не являются долгосрочным рентабельным вариантом.
Аккумуляторы стационарные. Стационарные батареи часто используются для аварийного питания или источников бесперебойного питания. Это батареи мелкого цикла, предназначенные для того, чтобы оставаться почти полностью заряженными в течение большей части своего срока службы с лишь периодическими глубокими разрядами. Их можно использовать в фотоэлектрических системах, если размер аккумуляторной батареи не опускается ниже DOD от 10% до 25%.
Батареи глубокого разряда. Батареи глубокого разряда должны обеспечивать срок службы в несколько тысяч циклов при высоком уровне разряда (80% или более).Значительные различия в характеристиках цикла могут наблюдаться с двумя типами батарей глубокого разряда, поэтому следует сравнивать срок службы и степень разряда различных батарей глубокого разряда.
Свинцово-кислотный аккумулятор состоит из электродов из оксида свинца и свинца, погруженных в раствор слабой серной кислоты. Возможные проблемы со свинцово-кислотными аккумуляторами включают:
Газовыделение: выделение водорода и кислорода. Выделение аккумулятора газом приводит к проблемам с безопасностью и потере воды из электролита.Потеря воды увеличивает требования к обслуживанию батареи, поскольку воду необходимо периодически проверять и заменять.
Повреждение электродов. Вывод отрицательного электрода мягкий и легко повреждается, особенно в тех случаях, когда аккумулятор может постоянно или сильно двигаться.
Расслоение электролита. Серная кислота — тяжелая вязкая жидкость. По мере разряда батареи концентрация серной кислоты в электролите снижается, а во время зарядки концентрат серной кислоты увеличивается.Это циклическое изменение концентрации серной кислоты может привести к расслоению электролита, при котором более тяжелая серная кислота остается на дне батареи, а менее концентрированный раствор, вода, остается наверху. Непосредственная близость электродных пластин внутри батареи означает, что при физическом встряхивании серная кислота и вода не смешиваются. Однако контролируемое выделение газа электролита способствует смешиванию воды и серной кислоты, но его необходимо тщательно контролировать, чтобы избежать проблем с безопасностью и потерей воды.В большинстве свинцово-кислотных аккумуляторов требуется периодическая, но нечастая подача газа в аккумулятор для предотвращения или обращения вспять расслоения электролита в процессе, называемом «ускоренной» зарядкой.
Сульфатирование аккумулятора. При низком уровне заряда на свинцовом электроде могут расти крупные кристаллы сульфата свинца, в отличие от мелкозернистого материала, который обычно образуется на электродах. Сульфат свинца — изоляционный материал.
Разлив серной кислоты. Если серная кислота вытечет из батарейного отсека, это представляет серьезную угрозу безопасности.Гелеобразование или иммобилизация жидкой серной кислоты снижает вероятность разливов серной кислоты.
Зависание АКБ при низком уровне разряда. Если аккумулятор находится на низком уровне разряда после превращения всего электролита в воду, то точка замерзания электролита также падает.
Потеря активного материала с электродов. Потеря активного материала электродов может происходить в результате нескольких процессов. Одним из процессов, который может вызвать необратимую потерю емкости, является отслаивание активного материала из-за изменения объема между xxx и сульфатом свинца.Кроме того, xxx. Неправильные условия зарядки и выделение газа могут вызвать отслоение активного материала от электродов, что приведет к необратимой потере емкости.
В зависимости от того, какая из вышеперечисленных проблем является наиболее важной для конкретного приложения, соответствующие модификации базовой конфигурации батареи улучшают ее характеристики. В случае использования возобновляемых источников энергии указанные выше проблемы повлияют на глубину разряда, срок службы батареи и требования к техническому обслуживанию.Изменения в батарее обычно включают модификацию в одной из трех основных областей:
- изменения состава и геометрии электродов
- изменения в раствор электролита
- модификации корпуса или клемм аккумуляторной батареи для предотвращения или уменьшения утечки образующегося газообразного водорода.
Коррозия состоит из областей набора или восстановления / окисления, в которых обе реакции происходят на одном и том же электроде. Для аккумуляторной системы коррозия приводит к нескольким пагубным последствиям.Один из эффектов заключается в том, что он превращает металлический электрод в оксид металла.
Все химические реакции протекают как в прямом, так и в обратном направлении. Чтобы обратная реакция протекала, реагенты должны набирать достаточно энергии, чтобы преодолеть электрохимическую разницу между реагентами и продуктами, а также перенапряжение. Обычно в аккумуляторных системах вероятность возникновения обратной реакции мала, так как имеется несколько молекул с достаточно большой энергией. Однако некоторые частицы, хотя и маленькие, обладают достаточной энергией.В заряженной батарее существует процесс, с помощью которого батарея может быть разряжена даже при отсутствии нагрузки, подключенной к батарее. Количество разряжаемого аккумулятора при стоянии называется саморазрядом. Саморазряд увеличивается с увеличением температуры, поскольку у большей части продуктов будет достаточно энергии для протекания реакции в обратном направлении.
Идеальным набором химических реакций для батареи является тот, в котором существует большой химический потенциал, который высвобождает большое количество электронов, имеет низкое перенапряжение, спонтанно протекает только в одном направлении и является единственной химической реакцией, которая может произойти.Однако на практике есть несколько эффектов, которые ухудшают характеристики батареи из-за нежелательных химических реакций, таких как изменение фазы объема реагентов или продуктов, а также физическое движение реагентов и продуктов внутри батареи.
Во время химических реакций многие материалы претерпевают изменение либо в фазе, либо, если они остаются в одной и той же фазе, объем и плотность материала могут быть изменены в результате химической реакции. Наконец, материалы, используемые в батарее, в первую очередь анод и катод, могут изменить свою кристалличность или структуру поверхности, что, в свою очередь, повлияет на реакции в батарее.Многие компоненты в окислительно-восстановительных реакциях претерпевают изменение фазы во время окисления или восстановления. Например, в свинцово-кислотной батарее сульфат-ионы меняют свое состояние с твердой (в виде сульфата свинца) на раствор (в виде серной кислоты). Если сульфат свинца перекристаллизовывается где-нибудь, кроме анода или катода, то этот материал теряется для аккумуляторной системы. Во время зарядки только материалы, соединенные с анодом и катодом, могут участвовать в электронном обмене, и поэтому, если материал не касается анода или катода, он больше не может заряжаться.Образование газовой фазы в батарее также представляет особые проблемы. Прежде всего, газовая фаза обычно имеет больший объем, чем исходные реагенты, что вызывает изменение давления в батарее. Во-вторых, если предполагаемые продукты находятся в газовом переходе, они должны быть ограничены анодом и катодом, иначе они не смогут заряжаться.
Изменение громкости также обычно отрицательно сказывается на работе от батареи.
В стандартной свинцово-кислотной аккумуляторной батарее электроды погружены в жидкую серную кислоту.Несколько модификаций электролита используются для улучшения характеристик батареи в одной из нескольких областей. Ключевые параметры электролита, которые контролируют производительность батареи, — это объем и концентрация электролита, а также образование «плененного» электролита.
Изменения объема электролита можно использовать для повышения надежности батареи. Увеличение объема электролита делает батарею менее чувствительной к потерям воды и, следовательно, делает регулярное техническое обслуживание менее критичным.Увеличение объема батареи также увеличит ее вес и снизит удельную энергию батареи.
В батареях с «плененным» электролитом серная кислота иммобилизуется либо путем «гелеобразования» серной кислоты, либо с помощью «абсорбирующего стеклянного мата». Оба имеют меньшее выделение газа по сравнению с затопленными свинцово-кислотными аккумуляторами и, следовательно, часто встречаются в герметичных свинцово-кислотных аккумуляторах, не требующих обслуживания.
Желирование. В «гелеобразной» свинцово-кислотной батарее электролит может быть иммобилизован путем гелеобразования серной кислоты с использованием силикагеля.Загустевший электролит имеет преимущество в том, что снижается газообразование, и, следовательно, батареи не требуют особого обслуживания. Кроме того, расслоение электролита не происходит с гелевыми батареями, и поэтому ускоренная зарядка не требуется, а поскольку электролит загустевает, вероятность просыпания серной кислоты также снижается. Однако для того, чтобы еще больше снизить газообразование, в этих «гелевых» батареях также обычно используются свинцово-кальциевые пластины, что делает их непригодными для применения в условиях глубокого разряда.Еще один недостаток состоит в том, что условия зарядки гелеобразной свинцово-кислотной батареи необходимо более тщательно контролировать, чтобы предотвратить перезаряд и повреждение батареи.
Абсорбирующее матирование стекла. Вторая технология, которая может использоваться для иммобилизации серной кислоты, — это «абсорбирующий стекломат» или аккумуляторы AGM. В аккумуляторе AGM серная кислота поглощается матом из стекловолокна, который помещается между пластинами электродов. Аккумуляторы AGM обладают многочисленными преимуществами, в том числе возможностью глубокой разрядки без ущерба для срока службы, высокой скоростью заряда / разряда и расширенным температурным диапазоном для работы.Ключевым недостатком этих аккумуляторов является необходимость более тщательно контролируемых режимов зарядки и более высокая начальная стоимость.
Модулирующая структура электролита для водно-цинковых батарей сверхнизких температур
Low-T
t Конструкция решенияH 2 O содержит частично положительно заряженные атомы H и частично отрицательно заряженные атомы O. Н-связь (O – H ··· O) образуется между атомом O и атомом H соседнего H 2 O в результате электростатического взаимодействия, в основном 37 .Значительно отклоняясь от закона гидридов халькогенов (рис. 1а), вода имеет нелогично высокую температуру замерзания из-за большого количества Н-связей. При температуре ниже 0 ° C вода может легко превратиться в лед, что сопровождается образованием дополнительных 0,52 H-связей на H 2 O (дополнительное примечание 1). Таким образом, разрушение водородных связей в воде увеличило бы разрыв энергии преобразования между водой и льдом в термодинамике. Кроме того, зарождение льда, как начальная стадия замораживания, зависит от молекул воды с тетраэдрически координированной структурой, вырастающих в стопку гексагональных последовательностей 17 (дополнительный рис.1). Таким образом, регулирование количества водородных связей и уменьшение количества молекул воды, сильно связанных водородом, может достоверно подавить замерзание воды на кинетическом пути.
Рис. 1: Схема решения с низким T t .a Температура замерзания гидридов халькогенов. H 2 O заметно отклоняется от закона между температурой замерзания и молекулярной массой. Идеальная точка замерзания отмечена длинной линией. b Схема эволюции структуры воды и электролита и дизайн раствора с низкой температурой T t .Исходная водная сеть, связанная водородными связями, может легко трансформироваться в ледяную сеть при 0 ° C. После добавления ZnCl 2 сетка водородных связей разрывается из-за сильного взаимодействия между ионами и водой, в то время как взаимодействия ионов усиливаются. Уравновешивая водородные связи и ионные взаимодействия для модуляции T t , электролит при критическом \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) может работать при чрезвычайно низкой температуре. c Оптические фотографии различных \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) электролитов при 25 и −70 ° C.При -70 ° C электролит с низким / высоким значением \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) является твердым, а умеренный \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) (7,5–10 м) электролит остается жидким.
Обладая многовалентным зарядом и малым радиусом, Zn 2+ обладает большим электрическим полем и генерирует сильные электростатические взаимодействия с диполярной молекулой воды и, таким образом, перестраивает координационные структуры молекул воды вокруг ионов металлов. Атомы O удерживаются ионами металлов за счет гидратации и практически не участвуют в образовании Н-связей, что приводит к значительному снижению количества Н-связей.В принципе, по мере увеличения концентрации соли металла разрушается больше водородных связей в воде. Следовательно, ожидается, что электролит с восстановленными водородными связями останется в жидком состоянии при отрицательной температуре. Однако введение массы солей металлов — палка о двух концах. Физические характеристики раствора также ухудшаются из-за такого концентрированного содержания. Во-первых, усиленное взаимодействие между катионами и анионами приводит к высокой вязкости, что приводит к вредному процессу массопереноса и высокому T t 36,38,39 .Между тем, растворимость солей металлов значительно снижается при понижении температуры, а тенденция к вытеснению соли сильно ограничивает диапазон температур жидкости. Поэтому для получения раствора с низкой T t мы ввели хорошо растворимую соль — ZnCl 2 и учли как модуляцию водородных связей, так и взаимодействия катион-анион, реализовали максимальное ингибирование перехода жидкость-твердое тело. регулируя \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \). Как показано на рис.1b, исходная структура водородных связей воды нарушается из-за сильной диполь-дипольной силы между ионными частицами и молекулами воды, и возникают конфигурации сольватации Zn 2+ . Этот электролит в основном состоит из молекулы воды со слабым взаимодействием водородных связей, Zn (H 2 O) 2 Cl 4 2–, ZnCl + и Zn (H 2 O). 6 2+ . Слабая водородная связь снижает температуру замерзания воды, в то время как усиленные ионные взаимодействия повышают T t электролита.Таким образом, балансировка двух вышеуказанных аспектов может модулировать T t , а критическое значение \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) означает, что этот электролит может работать при чрезвычайно низкой температуре. , что проявляется в жидком электролите с умеренной \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) при –70 ° C (рис. 1в).
Структуры электролита и переходы твердое тело-жидкость
Рамановская спектроскопия была проведена для изучения эволюции водородных связей и образования конфигураций сольватации в электролите с увеличением \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \).На рис. 2а, б валентное колебание O – H молекул воды (3000–3700 см, –1 ) демонстрирует очевидный широкий пик, который часто сворачивается на три составляющих. Основываясь на предыдущих отчетах 40,41 , пик комбинационного рассеяния постепенно смещается в синюю сторону по мере ослабления взаимодействия водородных связей, поэтому волновые числа основного пика, расположенные на ∼3230, ∼3450 и ∼3620 см. −1 , соответствуют молекулам воды с сильные, слабые и не водородные связи соответственно. При добавлении ZnCl 2 пики сужаются до высоких частот, что указывает на уменьшение доли сильных водородных связей в растворе 42 .Для дальнейшего количественного определения воды в различных H-связанных состояниях, отношения рассчитываются на основе площади подобранных пиков (дополнительный рис. 2). На рис. 2с, сильно связанная водородом вода уменьшается, в то время как не связанная водородом вода увеличивается с увеличением \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \), что свидетельствует о постепенном разрушении водорода. -связь с концентрацией соли. Ядерный магнитный резонанс (ЯМР) 1 H также использовался в качестве чувствительного индикатора для дальнейшего изучения сети водородных связей в электролите 43,44 .Как мы видим, химический сдвиг 1 H в сильное поле как \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) из-за разрыва водородных связей между молекулами воды ( Дополнительный рис. 3). Кроме того, мы смоделировали различные \ ({\ mathrm {C}} _ {\ mathrm {ZnCl}} _ 2} \) электролит с помощью молекулярной динамики (МД). Интуитивно понятно, что снимки смоделированной жидкой фазы показывают массивное сокращение водородных связей за счет индуцирования ZnCl 2 (рис. 2d). В частности, для выявления локальной координации водородных связей молекул воды было исследовано распределение молекул воды с различным числом водородных связей (рис.2д). В чистой воде молекулы воды с 4 H-связями являются доминирующими и составляют воду с тетраэдрически координированной структурой, которая играет решающую роль в зарождении льда. При увеличении \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) количество Н-связей доминирующих молекул воды уменьшается до 2 и даже до 0 при 7,5 и 30 м \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) электролита соответственно. Таким образом, уменьшение количества 4 H-связанных молекул воды с увеличением \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) подавляет зарождение льда, что препятствует замерзанию воды с точки зрения кинетики.
Рис. 2: Структуры электролита, включая водородные связи и ионные взаимодействия.валентное колебание O – H для различных \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) электролитов. b Подгоняемое валентное колебание O – H, представляющее молекулы воды с сильными, слабыми и не водородными связями. c Доля воды, сильно связанной водородом, и воды, не связанной водородом. d Снимок МД моделирования воды и 30 м ZnCl 2 электролита. Красная линия представляет собой Н-связи. e Доля различных молекул воды, связанных водородом. f Рамановские пики, представляющие конфигурации сольватации Zn 2+ . г Установленные пики для 7,5 и 30 м ZnCl 2 электролита. ч Пиковое значение Zn (H 2 O) 2 Cl 4 2– , ZnCl + и полиядерного агрегата. i Число водородных связей и энергии электростатического взаимодействия, полученные с помощью МД-моделирования. j Рассчитанные взаимодействия между ионами и водой и энергии образования конфигураций сольватации Zn 2+ .
Конфигурации сольватации Zn 2+ в различных электролитах \ ({\ mathrm {C}} _ {\ mathrm {ZnCl}} _ 2} \) также раскрыты с помощью спектроскопии комбинационного рассеяния в диапазоне 200–450 см −1 35,45 . Как показано на рис. 2f, чистая вода не показывает пиков в этом диапазоне. Для сравнения, при введении ZnCl 2 новый пик на 284.0 см -1 появляется и продолжает увеличиваться с \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \), что соответствует образованию конфигураций сольватации Zn 2+ . По мере увеличения концентрации до 30 мкм начальный пик превращается в два пика, доказывая новый способ координации для Zn 2+ . Для более точной идентификации видов мы подобрали пики и взяли 7,5 и 30 м ZnCl 2 электролит в качестве примеров умеренного и высокого \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) электролит (рис.2g и дополнительный рис. 4). Для электролита 7,5 м ZnCl 2 есть три пика, расположенные при 284,9, 311,8 и 405,6 см −1 , представляющие Zn (H 2 O) 2 Cl 4 2– , ZnCl + и Zn (H 2 O) 6 2+ соответственно. Для почти насыщенной концентрации 30 м \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \), ZnCl 4 2– и многоядерный агрегат Zn – Cl, пики которого расположены на 236.4 и 334,3 см −1 , заменяет Zn (H 2 O) 6 2+ и ZnCl + . Возникающий полиядерный агрегат Zn – Cl предполагается как расплав / твердое тело ZnCl 2 45 . Из-за конкуренции между Cl — и молекулами воды за позиции, смежные с Zn 2+ , среднее количество координирующей воды вокруг Zn 2+ сокращается, а безводный ZnCl 4 2– и Многоядерные агрегаты Zn – Cl образуются с возрастанием \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \).Средние координационные числа Zn с O (H 2 O) и Cl рассчитаны на основе моделирования методом МД, демонстрирующего дегидратацию конфигураций сольватации Zn 2+ с помощью \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) возрастает (дополнительный рис. 5). Что еще более важно, значение пика комбинационного рассеяния для Zn (H 2 O) 2 Cl 4 2– и ZnCl + показано на рис. 2h, а смещение пиков в синий цвет показывает усиление ионных взаимодействий с увеличением \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) 38 , что также демонстрируется полной потенциальной энергией электростатического взаимодействия между катионами, анионами и молекулами воды при МД-моделировании (рис.2i). Как и водородная связь, усиленные ионные взаимодействия повышают T t электролита. Неизбежно существует критический \ ({\ mathrm {C}} _ {\ mathrm {ZnCl}} _ 2} \), способствующий слабым взаимодействиям водородных связей и ионов, который может достигать самого низкого T t и применяться к низким -температурный электролит.
Для выявления механизма разрыва Н-связи и образования конфигураций сольватации в результате введения ZnCl 2 , взаимодействия между ионами и водой были проведены с помощью расчета теории функционала плотности (DFT).Преобладает электростатическое взаимодействие, взаимодействие H 2 O-H 2 O (рассматриваемое как водородная связь) демонстрирует энергию связи –5,1 ккал моль -1 . По сравнению с молекулой воды без заряда, ионы демонстрируют более сильное электростатическое и индукционное взаимодействие и, следовательно, более высокие энергии связи 37 . Высокая энергия связи –98,5 ккал моль -1 между Zn 2+ и H 2 O наделяет Zn 2+ способностью разрывать Н-связи и воссоздает структуру электролита с сольватационными конфигурациями (рис. .2j). Также исследуются конфигурации сольватации Zn 2+ , включая Zn (H 2 O) 2 Cl 4 2–, ZnCl + , Zn (H 2 O) 6 2+ и ZnCl 4 2–. Высокая энергия пласта означает, что они находятся в стабильном и низкоэнергетическом состоянии, что делает их более стабильными и трудными для диссоциации на ионы и воду.
Чтобы продемонстрировать наш принцип дизайна для раствора с низким T t , характеристики и температура переходов твердое тело-жидкость различных \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) электролит был исследован с помощью дифференциального сканирующего калориметра (ДСК), который может конкретно выявить термодинамические изменения, сопровождаемые температурой 46,47 .На рис. 3а показано изменение температуры различных \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) электролита при повышении температуры от –150 до 20 ° C. Обнаружено, что электролит различных \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) демонстрирует различные переходы твердое тело-жидкость, включая плавление льда, переход стекло-жидкость и растворение солей. Обычно процессы таяния льда и растворения соли демонстрируют острые эндотермические пики, а переход стекло-жидкость проявляется как очевидная ступень, вызванная повышенной теплоемкостью 46 .Возникновение стеклования является результатом обильного существования низкоэнергетической структуры, которая приводит к захвату электролита в локальные минимумы энергии 48,49 . На рисунке 3b четко показано соотношение V-образной формы между основным T t и \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) и самым низким T t , равным −114. ° C достигается при критической концентрации 7,5 м3. Ниже 7,5 м в T t в основном преобладают восстановленные водородные связи. На высоте более 7,5 м T t увеличивается с увеличением \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \), поскольку T t этого \ ({\ mathrm { C}} _ {{\ mathrm {ZnCl}} _ 2} \) преобладают усиленные ионные взаимодействия.При малых \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) 1–5 м процесс нагрева включает два перехода твердое тело-жидкость — второстепенный процесс перехода стекло – жидкость ниже — 100 ° C и основной процесс таяния льда. В диапазоне \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) 7,5–20 м происходит только переход стекло – жидкость. Когда \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) равно 30 м, переходы твердое тело-жидкость включают второстепенный процесс перехода стекло-жидкость ниже –60 ° C и основной процесс растворения соли соответствует острому эндотермическому пику при 1.2 ° С. Конкретные значения T t приведены в дополнительной таблице 1. Для более интуитивной визуализации этих трех переходов применяется наблюдение in situ с помощью поляризационного микроскопа в соответствии с изотропией и анизотропией электролита в различных состояниях 50 (рис. 3c). Граница смеси льда и жидкости наблюдается на оптической фотографии 5-метрового электролита ZnCl 2 при –100 ° C, демонстрируя, что низкая \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _2} \) электролит во время охлаждения сначала подвергается замерзанию воды, а затем стеклованию оставшегося раствора (чей \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) больше, чем у электролита исходный раствор) при более низкой температуре.В электролите ZnCl 2 толщиной 7,5 м наблюдаются фрагменты с острыми краями и трещинами в стекле при –120 ° C, вызванные переходом жидкость – стеклование и сопутствующим разрушением хрупкого стекла. С повышением температуры острые края осколков сглаживаются и трещины восстанавливаются, что свидетельствует о превращении электролита из хрупкого стекла в подвижную жидкость. Отсутствие кристаллов при –120 ° C свидетельствует об образовании только стекла ZnCl 2 -H 2 O в 7.5 м ZnCl 2 электролита. При высокой концентрации 30 м ZnCl 2 электролит показывает осаждение солей во время охлаждения и превращается в две фазы твердого ZnCl 2 и электролита \ ({\ mathrm {C}} _ {{\ mathrm { ZnCl}} _ 2} \) <30 м, который претерпевает переход жидкость – стеклование при более низкой температуре. Фазовый состав раствора ZnCl 2 при различной температуре и концентрации был определен на основании данных ДСК и поляризационного микроскопа.
Фиг.3: Свойства переходов твердое тело-жидкость и механизм стеклования.Термодинамическое изменение и переход различных \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) электролитов при низкой температуре. a DSC-тест от -150 до 20 ° C при скорости нагрева 5 ° C мин. -1 . b Основной T t стих \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) и фазовый состав раствора ZnCl 2 при различной температуре и концентрации. c Наблюдение 5, 7 под поляризационным микроскопом.5 и 30 м ZnCl 2 электролита примерно при T t соответственно. Масштабная линейка 200 мкм. d Расчетные профили энергии выделенной фазы ZnCl 2 и H 2 O, а также одиночной фазы после растворения ZnCl 2 в H 2 O при 100 ~ 300 K. e Расчетный переходное состояние при переходе от стеклянного состояния к отделенному кристаллическому состоянию. f Траектория движения Zn 2+ в МД-моделировании при 100 и 300 К.
Чтобы в дальнейшем раскрыть необычный механизм стеклования электролита на основе ZnCl 2 , мы рассчитали изменение энергии 7,5 м ZnCl 2 электролита в различных состояниях с опорной точкой энергии ZnCl 2 (с) и H 2 O (l) при 300 K. Большой энергетический зазор между ZnCl 2 (s) + H 2 O (l) разделенной фазой и ZnCl 2 -H 2 O (водн.) фаза обеспечивает легкое растворение ZnCl 2 при 300 К.Когда температура снижается до 200 К, энергетическая щель резко уменьшается из-за замораживания H 2 O в отделенной фазе. При дальнейшем понижении температуры энергетический порядок меняется на противоположный, поскольку аморфное стекло является метастабильным 51,52 и обладает более высокой термодинамической энергией, чем кристаллизованный ZnCl 2 и лед. Однако для перехода от стекла к кристаллу необходимо преодолеть энергетический барьер для разделения фаз, который запрещен из-за ограниченного теплового движения при чрезвычайно низкой температуре (рис.3д, е). При 100 К выбранный Zn 2+ оседает и может перемещаться не более 0,5 Å вокруг начала координат, из которых 8,3 Å при 300 К (дополнительный рис. 6). В результате низкотемпературные спектры комбинационного рассеяния показывают, что вода и ионы связаны так же, как и в жидком состоянии, и с трудом могут образовывать кристаллизованный ZnCl 2 даже при –150 ° C (дополнительный рис. 7), из которых конфигурация достигает минимума энергии системы. Энергетический барьер и щель при кристаллизации стекла подразумевают, что она происходит при относительно высокой температуре и представляет собой экзотермический процесс, что подтверждается холодной кристаллизацией стекла ZnSO 4 -H 2 O при –52 ° C ( Дополнительный рис.8).
Низкотемпературные характеристики электролита и Zn-анода
Помимо предотвращения замерзания электролита, электрохимические характеристики LTE также важны для работы LTZB, особенно в отношении высокой ионной проводимости и хорошей совместимости с Zn-анодом. Чтобы оптимизировать и выбрать подходящий ЛТР с превосходной ионной проводимостью при низкой температуре, ионные проводимости различных \ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \) электролитов (1, 5, 7 .5, 10 и 30 м) и обычный электролит (2 м ZnSO 4 и 2 м Zn (CF 3 SO 3 ) 2 электролит) были испытаны в интервале температур –100 ~ + 60 ° C (рис. 4a и дополнительная таблица 2). Из-за затрудненной ионной проводимости полностью замороженного электролита при низкой температуре (дополнительный рисунок 9), 2 м ZnSO 4 и 2 м Zn (CF 3 SO 3 ) 2 электролит демонстрируют быстрое разложение ионная проводимость, равная 6.41 × 10 –9 и 3.79 × 10 –8 мСм см –1 при –40 и –60 ° C соответственно. Для сравнения, электролит на основе ZnCl 2 показывает относительно высокую ионную проводимость при –100 ~ + 60 ° C, за исключением электролита WIS с высокой концентрацией 30 мкм. Несмотря на то, что 1 и 5 м ZnCl 2 электролит замерзает при –12,6 и –46,0 ° C соответственно, они обладают высокой ионной проводимостью при низкой температуре, что является результатом ионной проводимости, поддерживаемой остающимся концентрированным электролитом ниже их основной T t .Между тем, наличие твердого льда препятствует ионной проводимости и делает их ионную проводимость на одну десятую меньше, чем у незамерзшего электролита ZnCl 2 при температуре -80 ° C с размером частиц 7,5 мкм. Хотя 10 м электролита ZnCl 2 имеет низкую T t ниже –100 ° C, он также показывает более быстрое снижение ионной проводимости, чем электролит 7,5 м ZnCl 2 . Основываясь на расширенном температурном диапазоне жидкой фазы и относительно низкой концентрации, электролит ZnCl 2 7,5 м3 показывает высокую ионную проводимость, равную 1.79 мСм см −1 при –60 ° C и 0,02 мСм см −1 даже при –100 ° C.
Рис. 4: Электрохимические характеристики LTE и анода из цинка.a Ионная проводимость различных электролитов в диапазоне температур от –100 до + 60 ° C. b Энергии активации ионной проводимости в различных электролитах при нормальной и низкотемпературной стадиях. c ЦВА асимметричной ячейки Zn || Cu при –70 ° C. d Профили напряжения покрытия / снятия Zn в асимметричной ячейке Zn || Cu при –70 ° C. e Циклические характеристики симметричной Zn || Zn ячейки при –70 ° C.
Чтобы точно показать эволюцию ионной проводимости с температурой, энергии активации ионной проводимости в электролите были рассчитаны на основе уравнения Аррениуса 3 . Как показано на рис. 4b, существует две стадии, включая стадию нормальной температуры и стадию низкой температуры, в которых показаны разные энергии активации. Конкретный температурный диапазон и энергия активации для различных электролитов указаны в дополнительной таблице 3.Из-за экспоненциальной зависимости между энергией активации и ионной проводимостью более низкая энергия активации при ионной проводимости подразумевает более высокую температурную независимость электролита, что повышает его низкотемпературные характеристики. Энергия активации на стадии I ясно показывает, что более высокая концентрация электролита ZnCl 2 вызывает более высокую энергию активации. Однако на стадии II 7,5 м ZnCl 2 электролит показывает самую низкую энергию активации 0,374 эВ, вызванную его незамерзающим свойством при температуре выше –100 ° C, что приводит к самой высокой низкотемпературной ионной проводимости среди вышеуказанных электролитов.Несмотря на то, что 10 м электролита ZnCl 2 размораживается в этом диапазоне температур, более высокая концентрация приводит к более высокой энергии активации (0,536 эВ), вызывая относительно низкую ионную проводимость. Частично замороженные 1 и 5 мкм электролиты ZnCl 2 также показывают большую энергию активации на стадии II, чем незамерзший 7,5 мкм электролит ZnCl 2 . 2 м ZnSO 4 и Zn (CF 3 SO 3 ) 2 полностью замороженный электролит показывают самую высокую энергию активации, равную 3.067 и 3.641 эВ на стадии II соответственно. Таким образом, для ЛТР требуются незамерзшие свойства и относительно низкая концентрация. Философия конструкции LTE может быть заключена как использование электролита с самой низкой концентрацией с предпосылкой поддержания жидкого состояния при сверхнизкой температуре, которая обладает низкой энергией активации и высокой ионной проводимостью. В результате мы выбрали 7,5 м электролита ZnCl 2 в качестве ЛТР для дальнейшего исследования его электрохимических характеристик.
Асимметричные и симметричные Zn-батареи были собраны с целью исследования Zn-совместимости LTE.Кривая циклической вольтамперометрии (CV) асимметричных Zn || Cu-аккумуляторов показывает обратимую окислительно-восстановительную реакцию цинкования / снятия покрытия (рис. 4c и дополнительный рис. 10), а также высокая плотность тока 1,8 мА · см -2 . достигается при –70 ° C. Для точной количественной оценки обратимости цинкования / снятия покрытия в LTE, кулоновская эффективность (CE) асимметричных Zn || Cu батарей была протестирована в общих подходах 53,54 . Высокий средний CE 97,93 и 99,52% достигается при 25 и –70 ° C, соответственно, и достигается долговременное покрытие / удаление цинка (рис.4d и дополнительный рис. 11). Высокая обратимость может быть приписана более высокой сольватационной структуре Zn 2+ и меньшему количеству свободного растворителя, обусловленному электролитом с более высокой концентрацией 35,36 (дополнительный рис. 12). Кроме того, были испытаны симметричные ячейки Zn || Zn на основе 2 м ZnSO 4 , Zn (CF 3 SO 3 ) 2 электролита и ЛТР (дополнительный рис. 13). Батареи с 2 м электролитом ZnSO 4 и Zn (CF 3 SO 3 ) 2 показывают резко повышенное перенапряжение и выход из строя батареи из-за полностью замороженного электролита.Несмотря на то, что симметричный аккумулятор, использующий LTE, демонстрирует повышенное перенапряжение из-за пониженной ионной проводимости и медленной кинетики осаждения / снятия цинка при низкой температуре, он продолжает работать при –90 ° C, демонстрирует надежную температурную стабильность и выдерживает циклическое переключение при –70 ° C в течение 450 h (рис. 4д). Высокая ионная проводимость, хорошая совместимость с Zn и широкое электрохимическое окно (дополнительный рис. 14) ЛТР демонстрируют его осуществимость в сверхшироком диапазоне температур от –100 до + 60 ° C.
Батареи с органическим катодом LTE и PANI
Плотность энергии полностью заряженных батарей в основном зависит от электрохимических характеристик материалов катода.Однако Zn 2+ с высоким зарядом демонстрирует медленную кинетику внедрения для неорганических материалов 55,56 , что приводит к быстрому снижению емкости при низкой температуре. В последнее время внимание уделяется органическим материалам для низкотемпературных аккумуляторов из-за того, что накопители заряда расположены в основном на поверхностных группах, и высокая емкость не зависит от температуры. 26,57,58 . Поэтому, опираясь на окислительно-восстановительный механизм трансформации структуры бензол / хинон и соответствующую компенсацию ионов, для построения LTZB был выбран ПАНИ.Конфигурации и окислительно-восстановительный механизм PANI | LTE | Zn показаны на рис. 5а.
Рис. 5: Механизм накопления энергии и характеристики аккумуляторов PANI | LTE | Zn.a Конфигурации и окислительно-восстановительный механизм аккумуляторов PANI | LTE | Zn. b Кривые разряд-заряд аккумуляторов PANI | LTE | Zn в диапазоне температур –90 ~ + 60 ° C. c Сравнение батарей с обычным электролитом и LTE в различных температурных характеристиках. d Циклические характеристики при –70 ° C и 0.2 A g –1 . e Схема собранной ячейки мешочка и светодиодами двух последовательно намотанных ячеек при –70 ° C. f Разрядно-зарядные кривые пакетного элемента PANI | LTE | Zn при 20, –20 и –70 ° C.
Структура полученного ПАНИ была охарактеризована спектроскопией комбинационного рассеяния света 59,60,61 (дополнительный рис. 15). Чтобы продемонстрировать механизм трансформации структуры бензол / хинон и его соответствие температуре, для аккумуляторов PANI | LTE | Zn применяется спектроскопия комбинационного рассеяния in situ при 20, –70 и –90 ° C.Обратимое изменение сигнала хинон / бензол катода PANI во время окислительно-восстановительного процесса при –70 ° C, что соответствует таковому при 20 ° C и чрезвычайно низкой температуре –90 ° C (дополнительное примечание 2 и рис. 16), демонстрирует высокая окислительно-восстановительная обратимость и хладостойкость катода ПАНИ. При трансформации внутренней структуры катод поддерживает баланс заряда за счет адсорбции / десорбции ионов, что подтверждается рентгеновской фотоэлектронной спектроскопией и электрохимическим микровесом на кристалле кварца in situ (дополнительные рис.17–18). В частности, механизм компенсации ионов во время разряда выражается как десорбция Zn (H 2 O) 2 Cl 4 2– и гибридная адсорбция H + / ZnCl + (дополнительное примечание 3), что дает накопитель энергии псевдоемкости в батареях PANI | LTE | Zn, что подтверждается циклической вольтамперометрией (дополнительный рис. 19). Несмотря на то, что катод из ПАНИ имеет одинаковый окислительно-восстановительный механизм при нормальной и низкой температуре, медленная кинетика массопереноса при низкой температуре приводит к ослабленным окислительно-восстановительным пикам и повышенной электрохимической поляризации.
На рисунке 5b показаны кривые заряда-разряда батарей PANI | LTE | Zn в диапазоне от 90 до +60 ° C, что соответствует зарегистрированной температуре поверхности земли от -89,2 ° C (Долина Смерти, Калифорния, США, 1913) до 56,7 ° C (станция Восток, Антарктида, 1983), и несколько батарей могут работать в таком жестком температурном диапазоне (дополнительный рис. 20). При высокой плотности тока 1 А г −1 емкости имеют быстрый спад, а кривые заряда-разряда становятся почти треугольными из-за пониженного ионного переноса ЛТР и повышенной электрохимической поляризации.Когда ток снижается до 20 мА g -1 , емкость восстанавливается до 106,2 мА ч g -1 при –70 ° C. Подробные характеристики производительности при –70 ° C показаны на дополнительном рис. 21. Даже если температура упадет до –90 ° C, батареи PANI | LTE | Zn все еще будут работать и будут иметь емкость 20,4 и 50,6 мА ч г — 1 при 20 и 10 мА g −1 соответственно. Для сравнения, батареи PANI || Zn с 2 м ZnCl 2 , ZnSO 4 и Zn (CF 3 SO 3 ) 2 тормозятся пониженной рабочей температурой (рис.5в). Отказ батареи происходит последовательно при –25 ° C для электролита ZnSO 4 и –50 ° C для электролита Zn (CF 3 SO 3 ) 2 , что согласуется с испытанием симметричного Zn-элемента. Аккумулятор на основе 2 м электролита ZnCl 2 показывает относительно высокую емкость, поскольку электролит включает две фазы при –50 ° C: твердый лед и раствор ZnCl 2 (\ ({\ mathrm {C}} _ {{\ mathrm {ZnCl}} _ 2} \)> 2 m, концентрация которого поддерживает жидкость при этой температуре), а жидкий раствор ZnCl 2 поддерживает работу батареи.Однако из-за того, что твердый лед препятствует ионной проводимости, аккумулятор сохраняет низкую емкость (44,2%), что свидетельствует о необходимости незамерзшего электролита для LTZB. Аккумулятор, в котором используется незамерзший LTE, демонстрирует превосходную устойчивость к низким температурам и сохраняет высокую емкость 64,7% при –50 ° C. Циклические характеристики батарей PANI | LTE | Zn при –70 ° C показаны на рис. 5d, а длительные циклы (~ 2000) достигаются с сохранением емкости ~ 100% при 0,2 A g -1 . Кроме того, ячейка мешочка 1.15 А ч изготавливается с многослойным электродом, уложенным друг на друга. На рис. 5e две последовательно соединенные ячейки могут питать светодиоды при –70 ° C. Ячейка-пакет PANI | LTE | Zn на 1,15 А ч может сохранять высокую емкость 0,50 А ч при –70 ° C (сохранение емкости 43,4%, рис. 5f). Этот пакетный элемент на основе LTE обладает устойчивостью к низким температурам, а плотность энергии пакетного элемента оценивается в 97,9 и 42,6 Вт · ч · кг −1 при комнатной температуре и –70 ° C соответственно в зависимости от массы активных материалов. (Плотность энергии 38.9 и 16,9 Вт · ч кг -1 при комнатной температуре и –70 ° C достигаются на основе общей массы элемента, дополнительная таблица 4). Чтобы расширить область применения LTE, кроме того, были исследованы батареи, связанные с общим неорганическим катодом V 2 O 5 · 1,6 H 2 O и LTE. Хотя низкотемпературное сохранение емкости аккумуляторов V 2 O 5 · 1,6 H 2 O | LTE | Zn (45,9% при –50 ° C) не может сравниться с аккумуляторами PANI | LTE | Zn , он показывает более высокое удержание емкости (68.6% при –25 ° C), чем при использовании 2 м ZnCl 2 , Zn (CF 3 SO 3 ) 2 и ZnSO 4 электролита (62,8, 12,7 и 0,4% при –25 ° C соответственно, дополнительный рис. 22). В результате превосходные низкотемпературные электрохимические характеристики аккумуляторов PANI | LTE | Zn, V 2 O 5 · 1,6 H 2 O | LTE | Zn и карманного элемента демонстрируют высокую универсальность LTE и возможность удовлетворить потребность в крупномасштабном применении в экстремально холодных условиях.
[решено] Почему автомобильные аккумуляторы замерзают и выходят из строя? — Домашний аккумулятор банк
Вы просто обожаете просыпаться утром и пытаться повернуть ключ в замке зажигания только для того, чтобы услышать, как батарея разряжается, или вообще ничего. Добро пожаловать в зиму и мороз!
Конечно, от холода автомобильный аккумулятор может работать тяжелее, но может ли он заморозить сам аккумулятор? Там кислота, правда? Он не должен замерзать, правда?
Автомобильный аккумулятор замерзнет, если его уровень заряда и температура достаточно низкие.Полностью заряженный аккумулятор на 12,7 В замерзнет при -70 ° F. Наполовину заряженный аккумулятор (12,0 В) может замерзнуть при 5 ° F, а полностью разряженный автомобильный аккумулятор (11,5 В) замерзнет при 32 ° F.
В этой статье я расскажу о том, почему автомобильный аккумулятор замерзает, если автомобильный аккумулятор выйдет из строя из-за замерзания, и что вы можете сделать, чтобы этого вообще не произошло.
Почему автомобильные аккумуляторы замерзают
Как я вкратце упомянул выше, автомобильные аккумуляторы способны физически замерзать, что означает, что они могут превращаться в лед внутри отдельных ячеек автомобильного аккумулятора. Раствор электролита, который на 75% состоит из воды и 25% серной кислоты, изменяет свою температуру замерзания в зависимости от степени заряда аккумулятора.
Думайте о пресной воде как о полностью разряженной батарее и полностью насыщенной соленой воде как о полностью заряженной батарее. Пресная вода замерзнет до 32 градусов по Фаренгейту, а полностью насыщенная соленая вода замерзнет до -6 градусов по Фаренгейту. Чем больше соли вы извлечете из соленой воды (зарядите ее в случае батареи), тем выше температура, при которой она замерзнет, как и в случае с батареей.
Полностью заряженный автомобильный аккумулятор снизит температуру примерно до -50–70 градусов по Фаренгейту (от -45 до -56 по Цельсию) или, может быть, немного больше, прежде чем электролит в автомобиле может превратиться в лед. Полностью разряженный аккумулятор может замерзнуть при температуре около 32 градусов по Фаренгейту (0 градусов по Цельсию).
Для большинства из нас проблема действительно возникает зимой, когда автомобильный аккумулятор не полностью заряжен и постоянно находится в состоянии частичного заряда. Полностью разряженный аккумулятор может замерзнуть при температуре около 32 ゚ F, что является точкой замерзания пресной воды.
Полностью заряженный автомобильный аккумулятор измеряет вольтметром около 12,7 В. Автомобильный аккумулятор с напряжением 12,0 вольт (который заряжен примерно на 50%) замерзнет примерно на 5 градусов по Фаренгейту.
Здесь вы можете посмотреть отличную статью о фактических температурах замерзания на основе заряда автомобильного аккумулятора.
Во многом это зависит от возраста и состояния автомобильного аккумулятора, а также от того, насколько хорошо вы его обслуживали на протяжении многих лет.
Также имейте в виду, что внутри автомобильного аккумулятора у вас есть 6 отдельных ячеек.У вас может быть 5 ячеек, которые находятся в отличном рабочем состоянии, и одна, которая слаба и никогда не держит полный заряд, и что одна неисправная ячейка может замерзнуть раньше других.
Еще одна вещь, о которой следует помнить, заключается в том, что, когда ваш автомобиль очень трудно завести в холодную погоду, не только аккумулятор изо всех сил пытается высвободить ток холодного пуска (CCA) (потому что низкие температуры увеличивают внутреннее сопротивление), но и ваше масло толще, чем обычно, и вашему автомобилю сложнее механически запустить .Помните, что поршни должны начать движение внутри цилиндров и им нужна смазка.
Средства для предотвращения замерзания автомобильного аккумулятора
Сочетание подогреваемого силиконового коврика автомобильного аккумулятора с термостатически управляемой розеткой, а также простого в установке нагревателя масляного поддона, подобного тому, что можно увидеть на Amazon, — отличный способ гарантировать, что ваш автомобиль будет максимально легко заводиться при очень низких температурах. .
После установки вы просто протягиваете удлинитель к автомобилю и сначала подключаете к розетке с термостатическим регулированием в качестве промежуточного звена между настенным шнуром и автомобильными обогревателями.Затем включите нагреватели в две розетки на розетке.
Выпускное отверстие специально предназначено для включения нагревателей только при слишком низких температурах, а затем снова отключается, когда температура повышается. Таким образом, вы будете нагревать аккумулятор и масляный поддон только при необходимости. Это простой процесс «установил и забыл», вам просто нужно не забывать подключать его каждый раз, когда вы приходите домой.
Если вы подозреваете, что ваша батарея не заряжается должным образом из-за ваших привычек вождения (короткие поездки на работу убивают автомобильный аккумулятор), то я рекомендую это зарядное устройство с функцией быстрого отключения, чтобы вы могли оставить концы зарядного устройства. постоянно подключенный к аккумулятору, и просто отсоедините зарядное устройство с помощью простого зажима, когда будете готовы уйти.
Я использую это зарядное устройство более 5 лет, и оно великолепно! Он полностью зарядит вашу батарею за 8-10 часов после полной разрядки, и ее можно подключать бесконечно, не повредив батарее.
Ваши привычки вызывают замерзание аккумулятора автомобиля
Низкие температуры, очевидно, являются основной причиной, по которой ваш автомобильный аккумулятор замерзает, но, как мы говорили ранее, состояние заряда действительно имеет прямое отношение к тому, замерзнет ваш аккумулятор для всех практических намерений и целей.
Чем выше уровень заряда аккумулятора, тем более низкую температуру он может выдерживать. Вы не поверите, но привычки вождения , вероятно, являются фактором номер один с состоянием заряда вашего аккумулятора.
Каждый раз, когда вы заводите свой автомобиль, особенно в холодную погоду, из автомобильного аккумулятора выливается больше энергии, и ее необходимо восполнять с помощью генератора переменного тока. Если зимой вы ездите по делам и заводите машину 5 или 6 раз, чтобы добраться до 5 разных мест, и никогда не водите машину дольше нескольких минут, прежде чем вернуться домой, то аккумулятор в вашей машине может разрядиться. заряд 90% (при условии, что в этом примере вы начали со 100%).
Сделайте это в течение нескольких дней и объедините это с паразитическим воздействием, которое происходит, когда ваша машина даже не работает от радиочасов и противоугонной системы, а ваш заряд падает еще больше. Вы можете увидеть, как можно очень быстро снизить уровень заряда до 50%. Не удивляйтесь, если в одну из таких ночей у вас замерзнет аккумулятор в автомобиле, и вам будет не до утра, чтобы проснуться.
Разрушается ли автомобильный аккумулятор, если он замерзает?
Если автомобильный аккумулятор просто сильно остынет, но не замерзнет физически, то он вообще не получит больших физических повреждений.Батареи труднее принимать заряд от зарядного устройства или выделять электричество, когда вы поворачиваете ключ. Автоаккумулятор просто действует вяло.
Вы, вероятно, заметите это, когда возьмете мобильный телефон и подержите его в руке в холодную погоду зимой. Вы заметите, что процент заряда батареи вашего телефона падает экспоненциально быстро. Дело не в том, что аккумулятор телефона действительно так быстро разряжен, телефон просто не распознает заряд, потому что он не может так быстро потреблять ток от аккумулятора из-за холода, и сенсорам в телефоне кажется, что аккумулятор более мертв, чем есть на самом деле.
Снова прогрейте телефон, подключив его к зарядному устройству, и вы заметите, что он заряжается очень быстро, потому что на самом деле заряжать особо нечего.
Теперь, если автомобильный аккумулятор физически замерзает и превращается в лед внутри ячеек, то да, автомобильный аккумулятор может быть непоправимо поврежден, и, более чем вероятно, вы захотите приобрести новый аккумулятор. Я бы не поверил, что автомобильный аккумулятор, который физически замерз, останется под капотом моей машины.
Помните, что когда вода замерзает, она расширяется, и внутри автомобильного аккумулятора у вас есть связка тонких свинцовых пластин и 6 ячеек, в которых размещены эти пластины, которые очень плотно прижаты друг к другу, и у вас не так много места для маневра.
Когда лед кристаллизуется и расширяется, он толкает эти свинцовые пластины друг в друга, он толкает стенки самой батареи и заставляет ее вздуваться, он толкает элементы друг в друга и, возможно, даже разрывает их. Вероятность того, что ваша батарея выйдет из строя изнутри и больше никогда не будет заряжена должным образом, очень высока, если вашей батарее позволили полностью замерзнуть и превратиться в лед.
Как узнать, замерзла ли автомобильная батарея
Очевидно, что визуальный осмотр — это самый простой способ определить, не замерз ли аккумулятор вашего автомобиля. Конечно, вы захотите надеть защитные очки, когда имеете дело с 12-вольтовым автомобильным аккумулятором (особенно если это залитый аккумулятор со съемными крышками для проверки электролита).
Сначала проверьте боковины аккумулятора и посмотрите, не выпирают ли они. Если это так, это явный признак того, что лед расширился внутри ваших клеток и давит на стенки вашей батареи.Но также убедитесь, что вы правильно прикрепляете выпуклые стенки батареи к холодной погоде. Стены вашей батареи могут выпирать из-за длительного перезаряда, так как газы не могут уйти достаточно быстро, что может произойти, если вы не используете подходящее интеллектуальное зарядное устройство.
Вы также можете отсоединить аккумулятор и пролить его вокруг и прислушаться к любой жидкости внутри. Это особенно верно, если у вас залитый свинцово-кислотный аккумулятор, и вы должны слышать брызги электролита. Если вы его не слышите, то, скорее всего, он заморожен.
Если у вас залитый свинцово-кислотный аккумулятор, вы также можете открыть крышки сверху, чтобы проверить кислотность аккумулятора внутри, и вы можете визуально осмотреть с помощью фонарика, чтобы увидеть, есть ли лед.
Безопасно ли заряжать замерзший аккумулятор
НИКОГДА не безопасно заряжать автомобильный аккумулятор, в элементах которого есть лед, или пытаться перепрыгнуть с него. Сделав это, вы рискуете взорваться.
В большинстве качественных интеллектуальных зарядных устройств есть микропроцессоры, которые сначала попытаются определить базовое напряжение вашей батареи, прежде чем они даже начнут откачивать зарядный ток.Скорее всего, если в вашей батарее возникнет лед, они даже не начнут процесс зарядки. Но рисковать не стоит.
Старые зарядные устройства, в которых нет этой функции безопасности, позволяющей сначала определить базовое напряжение от батареи, в любом случае будут откачивать зарядный ток, что может привести к взрыву. То же самое относится к использованию соединительных кабелей от аккумулятора и генератора другого автомобиля, которые будут откачивать ток независимо от того, может ли ваш аккумулятор (который заморожен) принять.
Если ваш автомобильный аккумулятор замерз до такой степени, что стены вылезают наружу, я бы даже не рискнул попытаться зарядить его даже после того, как разморозил его внутри.
Если вы не видите никаких внешних структурных повреждений автомобильного аккумулятора и знаете, что внутри него есть лед (но не уверены, полностью ли он замерз), то, возможно, стоит попробовать зарядить аккумулятор после того, как он разрядится. полностью оттаял. Внимательно следите за зарядом, и я рекомендую постоянно подключать цифровой вольтметр, чтобы вы могли видеть состояние заряда в процессе работы.
Когда закончите, отключите зарядное устройство и подождите пару часов, прежде чем проверять напряжение, и используйте ареометр, чтобы проверить удельный вес каждой из ячеек, чтобы увидеть, действительно ли они все еще держат заряд. Если у вас герметичный аккумулятор, вы не сможете выполнить этот последний шаг с ареометром, и вам просто нужно будет использовать вольтметр для проверки открытого напряжения между положительной и отрицательной клеммами, чтобы получить наилучшее предположение из дома, не подвергая его воздействию. к фактическому нагрузочному тесту.
Вы всегда можете отнести аккумулятор к автомеханику и попросить его провести нагрузочный тест аккумулятора, чтобы проверить его общее состояние.
Как предотвратить замерзание автомобильного аккумулятора
[Ссылки на рекомендуемые мной продукты для предотвращения замерзания автомобильного аккумулятора находятся в верхней части статьи.]
Активные меры по предотвращению замерзания автомобильного аккумулятора — определенно лучший подход, если вы живете в холодном климате или в регионах с суровыми зимами.
Одеяло или подушка автомобильного аккумулятора предназначены для создания теплового барьера между холодной погодой и автомобильным аккумулятором и генерируют небольшое количество тепла, которое будет держать аккумулятор готовым к высвобождению достаточной силы тока холодного пуска для легкого запуска автомобильного аккумулятора.
Как мы уже говорили, не забывайте о масле. Тот факт, что автомобильный аккумулятор поддерживается в тепле и может выделять достаточное количество холодного пускового тока, не означает, что ваш автомобиль механически захочет соответствовать требованиям, особенно если масло загустевает при более низкой температуре.
Убедитесь, что у вас есть подходящее зимнее масло для вашего автомобиля. Рекомендуемый вес масла можно найти в руководстве пользователя.
Рассмотрите возможность установки клейкого нагревателя масляного поддона, чтобы поддерживать температуру масла, идеальную для запуска в холодную погоду.
Вы можете пойти еще дальше и приобрести зарядное устройство с быстроразъемными кабелями, которое жестко закреплено на автомобильном аккумуляторе, чтобы вы могли заряжать аккумулятор каждую ночь после возвращения домой.
Наконец, помните о своих привычках вождения. Если вы едете 30 минут до города и 30 минут обратно, ваша батарея будет почти полностью заряжена, если это ваша обычная привычка.

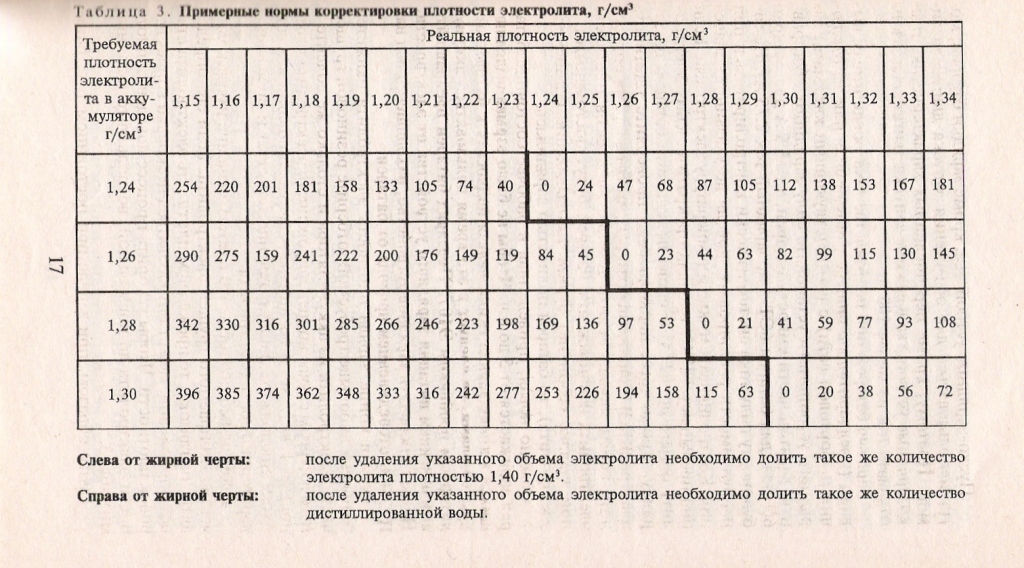 Сопротивление холодного мотора зимой возрастает в 2.5-3 раза;
Сопротивление холодного мотора зимой возрастает в 2.5-3 раза;