Инструкция проверки ОСАГО на подлинность по базе РСА
В сегодняшней публикации дадим вам подробную инструкцию о том, как проверить полис ОСАГО по номеру.
Для чего нужна такая проверка? Каждый автолюбитель несёт ответственность за владение оригинальным полисом. Для владельцев поддельных сертификатов закрыт путь к получению страховой выплаты в случае аварии. Все разрушения от ДТП виновник с поддельным полисом должен будет возмещать из собственного бюджета. К тому же, за предъявление неоригинального документа сотруднику ГИБДД предусмотрена уголовная ответственность.
Обратите внимание: если вы выяснили, что ваш полис – подделка, то как можно скорее обратитесь в ОВД и сообщите о том, что столкнулись с мошенничеством.
Официальная проверка полиса по базе РСАВсе страховые свидетельства, начиная с 01.09.2021 г., вносятся в Единую систему Российского союза автостраховщиков. Для формирования этой базы компании-страхователи передают информацию о заключённых договорах в РСА.
Проверяются страховые полиса ОСАГО по номерам на сайте РСА. Для установления подлинности вам понадобятся реквизиты документа.
Последовательность проверки следующая
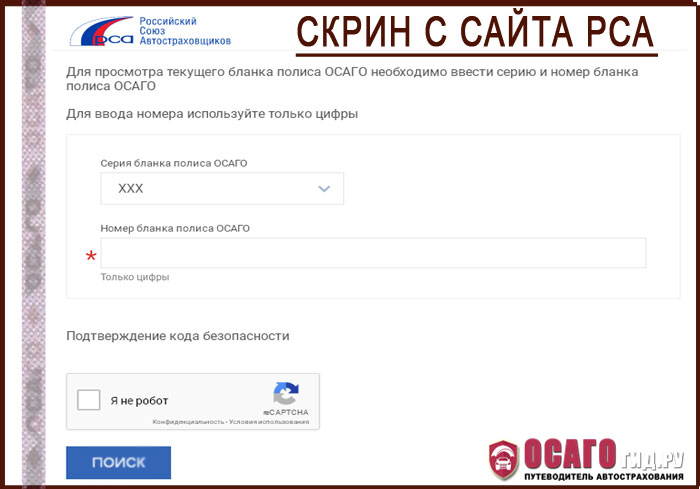
1. На главной странице официального сайта РСА находите блок «Проверка полисов ОСАГО». Нажимаете на кнопку «Проверить»
2. В открывшееся поле вводите серию, номер документа. Для проверки потребуется ввести дату, на которую необходимо получить данные.
3. Поставьте галочку, чтобы система убедилась в том, что вы не робот.
4. Нажмите на кнопку «Поиск».
5.Получите заключение о проверке.
Таким образом вы можете проверить ОСАГО любого автолюбителя, выяснить список людей, вписанных в полис и имеющих право управлять этой машиной. А также выяснить, не записано ли на один и тот же номер несколько машин.
По результатам проверки вы получите один из следующих статусов полиса:
- «Подлинный».
 Полис оригинальный, находится у владельца транспортного средства.
Полис оригинальный, находится у владельца транспортного средства. - «У страховщика». ОСАГО у компании-страховщика либо компания не внесла информацию о нём в базу РСА. В таком случае проверьте подлинность повторно через пару дней.
- «Утратил силу». Документ прекратил своё действие. Информацию о том, почему это произошло, уточните, проверив, что за автомобиль застрахован по данному полису.
- «Утерян». Владелец полиса уведомил компанию-страховщика о том, что документ утерян.
- «Напечатан производителем». Страховщик ещё не получил бланк ОСАГО.
Теперь проверим страховку по данным автомобиля. Так вы поймёте, какой страховщик выдал ОСАГО.
Последовательность действий для проверки будет такой:
1. Выберите вкладку «Реквизиты транспортного средства».

2. Чтобы понять, вписан ли водитель в полис, проставьте соответствующую галочку.
3. Внесите необходимые данные в соответствующие поля.
Инструкция по проверке КБМИтоговая стоимость договора ОСАГО зависит от коэффициента бонус-малус (КБМ). Он может быть снижен или увеличен в зависимости от числа ДТП или выплат по страховке, произошедших после заключения договора.
Каждый год этот коэффициент разный. Самое приятное максимальное значение КБМ – это 0,5. При таком коэффициенте автовладелец оплачивает лишь половину стоимости ОСАГО. Чтобы получить такой коэффициент, стаж вождения страхователя без ДТП должен быть 10 лет. Соответственно, за каждый год безаварийной езды автолюбитель получает скидку по КБМ в размере 5%.
Неприятно узнать о том, что скидки по КБМ у водителя больше нет. Такое иногда случается. Поэтому стоит проверить данные, которые присутствуют в базе РСА и выяснить свой коэффициент.
Как восстановить КМБ и получить скидку по ОСАГО
Для проверки КБМ необходимо:
1.
2. Заполнить соответствующие графы для физических или юридических лиц. Нажать на кнопку «Проверить бесплатно».
Для проверки КБМ физического лица понадобятся:
- Фамилия, имя и отчество;
- Дата рождения;
- Водительское удостоверение (его серия и номер).
Диагностическая карта подтверждает, что автомобиль прошёл технический осмотр. Без наличия такой карты заключить договор ОСАГО невозможно. К тому же, выезжая на дорогу без этого документа, вы рискуете получить штраф.
Можно ли получить диагностическую карту онлайн в 2021 году
Наличие диагностической карты в базе РСА на нашем сервисе проверяется онлайн, это бесплатно.
Пользуйтесь бесплатными инструментами проверки подлинности документов, полученных в страховой компании. И будьте уверены, что в случае неприятного происшествия на дороге, ваш ОСАГО послужит вам отличной подушкой безопасности.
ОСАГО онлайн на сайте e-osago.ru
Большой выбор страховых компаний, низкие цены, получение страхового полиса на e-mail
Проверить полис ОСАГО на подлинность ➤ Neacar
В последнее время выросло число непризнанных страховых договоров, которые были заключены от имени страховых компаний. Это указывает на то, что страхователь попал на мошенников. Чтобы в будущем избежать этих ситуаций, необходимо уметь проверить полис ОСАГО на подлинность РСА или другими доступными методами.
Обязательно ли проверять ОСАГО на подлинность
Проверка подлинности ОСАГО важна по той причине, что, если документ будет поддельным, по нему не предусмотрено наступление страховой выплаты. Если владелец авто попадет в дорожно-транспортное происшествие, возмещение причинённого вреда будет возложено исключительно на него. Поддельным может быть и сам полис, если его просто напечатали, так и настоящий документ, который потеряли или похитили.
Поддельным может быть и сам полис, если его просто напечатали, так и настоящий документ, который потеряли или похитили.
Во избежание таких ситуаций, приобретать стоит незаполненный бланк, не нужно отдавать предпочтение страховке по заниженной цене от указанной в квитанции, в бланке.
Мы оформляем страховые полюсы, оказываем помощь в покупке автомобиля и предлагаем другие услуги, которые востребованы среди наших клиентов.
Способы проверки ОСАГО
Проверка полиса ОСАГО на подлинность может быть осуществлена несколькими способами, в частности:
- Визуальная проверка
Страховка оформляется на специальном бланке, в вертикальном направлении на левой части документа должна проходить металлизированная полоса.
Водяные знаки и логотип РСА хорошо видны на свету, а номер бланка качественно выдавлен и прощупывается.
Оформляют документы серии МММ, ККК, ХХХ – это показатель оригинальности. Никакие другие серии не могут быть применены.
Никакие другие серии не могут быть применены.
Текст, напечатанный на бланке, должен быть грамотно прописан, без ошибок, опечаток, неточностей, с выдержанными полями и границами.
Печать страховщика, полное юридическое название организации и все реквизиты – обязательная составляющая документа.
Для получения достоверного результата должны быть безупречно выполнены все вышеуказанные пункты. При отклонении даже от одного из них, можно говорить о подделке.
- Проверка электронного полиса ОСАГО
На электронных документах присутствуют специальные QR-коды, которые оригинальны для каждого отдельно взятого документа. Чтобы проверить полис ОСАГО на подлинность онлайн, нужно установить приложение «ДТП Европротокол» на ваше мобильное устройство и считать код, программа отобразит все сведения, информацию, которая прописана и в полисе.
- Проверка полиса в РСА
Проверка подлинности полиса ОСАГО по базе РСА – это самый качественный и достоверный способ. В данном случае, в специальной форме указывают данные документа – его серию и номер, отправляют данные в обработку и получают ответ – есть ли он в базе, какой его статус на момент запроса, какая конкретно компания оформила.
В данном случае, в специальной форме указывают данные документа – его серию и номер, отправляют данные в обработку и получают ответ – есть ли он в базе, какой его статус на момент запроса, какая конкретно компания оформила.
Можно столкнуться с мошенничеством, когда продан «двойник полюса» — то есть система находит соответствия по серии и номеру, однако оформлен он на совершенно другого человека.
- По номеру транспортного средства
Проверить подлинность полиса ОСАГО по номеру государственной регистрации, VIN автомобиля – это максимально информационный метод. После введения всей информации на экран будут выведены все данные о страховом полюсе и автотранспортном средстве, а также о страховой компании, в которой документ был оформлен.
Проверка ОСАГО онлайн
Наша компания предлагает на сайте в интернете проверить подлинность ОСАГО онлайн. Таким образом, вы получите всю необходимую информацию об оформленном документе, убедитесь в его достоверности и подлинности. Проверка страховки предполагает введение номера автомобиля и другой индивидуальной информации, которая идентифицирует транспортное средство и его владельца. Также через наш сайт осуществляется проверка КБМ – быстро и просто.
Проверка страховки предполагает введение номера автомобиля и другой индивидуальной информации, которая идентифицирует транспортное средство и его владельца. Также через наш сайт осуществляется проверка КБМ – быстро и просто.
Оплата онлайн
Оформление страховых договоров через интернет создает новые возможности для удобной покупки страховых полисов через интернет. Это обеспечивает сразу несколько принципиальных преимуществ перед традиционной формой заключения страхового договора. При покупке страховки онлайн из процесса отношений страховой компании и клиента исключается всевозможные посредники, такие как агенты и брокеры, клиент получает всю информацию о страховых продуктах и правилах страхования из первых рук, а стоимость полиса в ряде случаев может быть ниже, благодаря снижению издержек на операционные расходы в страховой компании. Кроме того, при покупке страхового полиса напрямую исключается возможность мошенничества, связанного с продажей полисов на поддельных бланках.
Покупка и доставка полиса
Процесс заключения страхового договора через интернет, оплаты страховой премии и доставки страхового полиса регулируется общими положениями гражданского законодательства РФ, а также специальными федеральными законами и поправками в сфере организации страховой деятельности. Большинство видов страховых полисов могут быть оплачены и получены клиентом в электронном виде, в том числе и электронное ОСАГО, после получения соответствующего договора-оферты и его акцептирования. В тоже время некоторые особенности условий доставки базируются на законодательных ограничениях.
Покупая страховой полис через интернет вы получите на свой адрес электронной почты электронную версию полиса в формате pdf. Вы в любое время можете убедиться в подлинности полиса через форму проверки по номеру бланка на сайте компании или обратившись в контактцентр по телефону.
Осуществление электронного платежа осуществляется на сайте платежной системы банка-эквайера. Соединение с сайтом платежной системы осуществляется по защищенному протоколу https. и является полностью безопасным.
Соединение с сайтом платежной системы осуществляется по защищенному протоколу https. и является полностью безопасным.
Для осуществления платежа Вам потребуется сообщить данные Вашей пластиковой карты. Передача этих сведений производится с соблюдением всех необходимых мер безопасности. Данные будут сообщены только на авторизационный сервер Банка по защищенному каналу (протокол TLS). Информация передается в зашифрованном виде и сохраняется только на специализированном сервере платежной системы. Сайты и магазины не знают и не хранят данные по вашей пластиковой карте.
Безопасность
Высокие требования к безопасности хранения и обработки персональных данных – один из важнейших принципов в политике компании «Зетта Страхование». Выбирая вариант страхования в онлайн, вы можете быть уверены в том, что никто из посторонних лиц не получит доступ к вашей конфиденциальной информации.
Дополнительные расходы
За оплату полиса онлайн, а также его доставку в электронной или бумажной форме дополнительных плат или комиссий не взимается. Вы оплачиваете только сам полис.
Вы оплачиваете только сам полис.
Возврат денежных средств
При отказе от приобретенного ранее полиса вы можете досрочно расторгнуть страховой договор и вернуть свои средства за оставшийся период действия страхового договора. С порядком и условиями возврата денежных средств вы можете ознакомиться в правилах страхования по вашему страховому договору. Возврат денежных средств осуществляется в безналичной форме. Клиент может использовать для возврата ту же банковскую карту, с которой была произведена оплата покупки на сайте. Для получения возврата денежных средств воспользуйтесь формой заявки на сайте или обратитесь в контакт центр по телефону.
Вы можете воспользоваться банковскими картами: VISA, MASTERCARD
Online проверка подлинности полиса ОСАГО
Войти Войти Регистрация Забыли пароль? Запомнить меня- Новости
- База знаний
- Блоги
- Видео
- Форум
- Компании
- RenaultSport
- Лента
- Скидки
- Электромобили
- История
- Тест-драйвы
- Краш-тесты
- Концепты
- АвтоПраво
- Rally
- Код магнитолы
- Проверка VIN
Проверка полиса ОСАГО — Программа для проведения выездного техосмотра и автострахования с выгрузкой в ЕАИСТО
Проверка подлинности полиса ОСАГО проводится бесплатно
Разъяснения по вопросам принадлежности полиса ОСАГО страховой организации можно получить в отделе по учету БСО по телефону (495) 771-69-44 доб.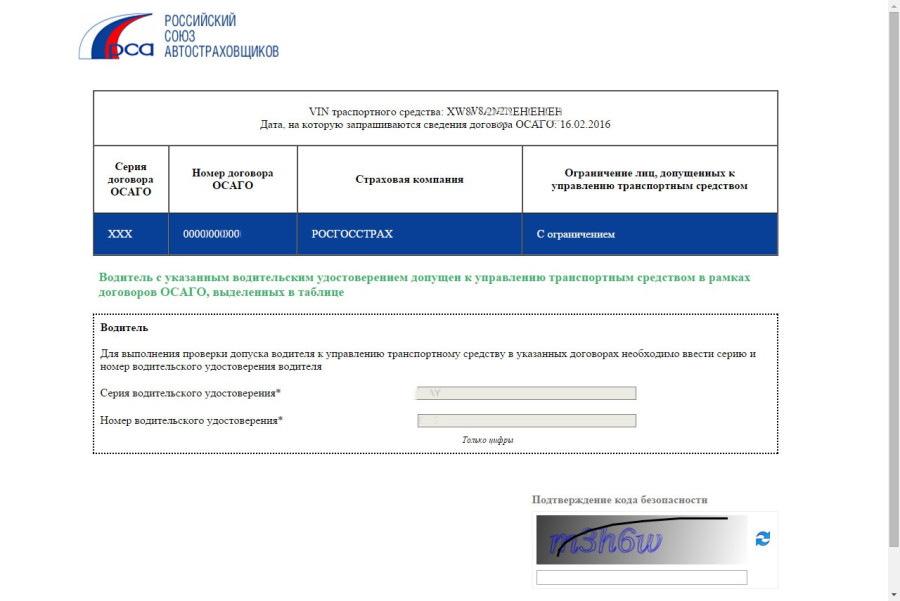 717, или 754
717, или 754
Если Вы стали владельцем бланка полиса ОСАГО:
— поддельного,
— недействительного (утрачен, украден, испорчен),
— принадлежность которого не совпадает с информацией о страховой организации, указанной на полисе,
сообщите об этом в РСА по телефону — (495) 771-69-44 доб. 151
Или по электронной почте – [email protected]
Зачем нужно проводить проверку полиса ОСАГО
Мошенники действуют в различных сферах, в том числе и в сфере страхования авто.
Как правило, их действия направлены через страховых агентов.
Ими может быть предложена большая скидка, однако не спешите отдавать деньги.
Только подтвердив подлинность документа по его номеру, можно доверять страхователю.
В противном случае, вы вынуждены будете в случае ДТП по вашей вине самостоятельно возмещать ущерб пострадавшей стороне, так как страховая компания ответственности в данном случае не несёт.
Проверка позволит определить, зарегистрирован ли ваш полис ОСАГО в едином реестре.
Если нет, необходимо сообщить о мошенничестве в соответствующие органы.
Если полис ОСАГО недействителен.
Вам продан украденный или страховщик лишен лицензии на момент продажи, то в случае вашей виновности в ДТП ни страховщик, ни РСА за вас ничего не заплатит потерпевшему. В этом случае оплачивать ущерб вы будете сами.
Кроме того, если вы сознательно покупаете фальшивый полис ОСАГО, то можете попасть под уголовное наказание. Согласно статье 327 Уголовного кодекса использование заведомо подложного документа наказывается штрафом в размере от 100 до 200 МРОТ или в размере зарплаты за 1-2 месяца, либо обязательными либо исправительными работами.
Хотя сами бланки полисов защищены от подделок, однако от воровства нет защиты.
Поэтому по самому бланку полиса, покупаемого на улице, вы не сможете определить его подлинность. В этом поможет сервис по проверке принадлежности полиса ОСАГО страховой компании.
Если во время ДТП вы оказались потерпевшим, то до обращения к страховщику вы также можете проверить подлинность полиса ОСАГО. Так вы будете готовы к отказу в выплате и сможете начать подготовку иска в суд на виновника ДТП.
Так вы будете готовы к отказу в выплате и сможете начать подготовку иска в суд на виновника ДТП.
Таким образом, сервис по проверке принадлежности полиса ОСАГО страховой компании необходим каждому автовладельцу.
Теперь можно при приобретении полиса у агента или разбирательствах после аварий идентифицировать бланк полиса ОСАГО.
Что вы увидите?
Главное вы увидите и проверите, что полис выдан действительно для страховой компании, с которой вы заключили договор. Естественно полис должен быть выдан в период за 3-5 месяцев до заключения с вами договора. Этот срок нужен для нормальной его доставки от типографии до страхового агента.
Что должно насторожить:
Несовпадение наименования компании в форме запроса и вашим полисом. Возможна подделка полиса.
Слишком большой срок от выдачи полиса в страховую компанию, по заключения договора. Более 6 месяцев. Возможна выдача ворованного или утраченного полиса.
Ваши действия:
Если возникли подозрения относительно действительности вашего полиса или правильности расчета страховой премии вы можете позвонить мне для консультации или обратиться непосредственно в страховую компанию.
Правда есть такие страховые компании, которые даже не указывают свой контактный номер телефона на полисе. Обычно он написан в угловом штампе, в левом верхнем углу полиса.
Вам нужно уточнить у сотрудника страховой компании, проведен ли ваш полис по их базе учета. Обычно это занимает минут 5-10. Можно официально написать на сайт компании это вопрос. В нормальных страховых компаниях ответ на этот вопрос не вызывает проблемы.
Как избежать проблем?
Чтобы не переживать за свои деньги потраченные на покупку полиса ОСАГО или возможных последствиях его отсутствия лучше всего страховаться с моей помощью.
Вам действительно будет предоставлена качественная услуга. Конечно, это ваш выбор и я не собираюсь на него влиять, я только готова помочь вам сделать его правильно.
В жизни бывает всякое, надеюсь проверка полиса прошла успешно и вас миновала встреча с неожиданным.
проверить полис осаго
проверить страховой полис осаго
проверить полис осаго на подлинность
проверить номер полиса осаго
проверить полис осаго росгосстрах
проверить полис осаго в рса
проверить номер страхового полиса осаго
проверить действительность полиса осаго
проверить действие полиса осаго
проверить бланк полиса осаго
Как можно проверить свой страховой полис.
 Проверьте политику CTP на подлинность RSA
Проверьте политику CTP на подлинность RSAПроверка полиса ОСАГО — это гарантия того, что вы будете надежно защищены от любых неприятностей в дороге. Осаго чек необходимо сразу после получения страхового полиса, без промедления. Только в этом случае вы можете быть уверены, что обезопасили себя от подделки и риска невыплаты компенсации.
Мы гарантируем всем нашим клиентам услуги высочайшего качества и даем возможность проверить OSAGO RSA в любое время. Убедитесь, что ваш полис является полностью законным и действительно принадлежит выбранной вами страховой компании сразу после того, как наш агент принесет его вам. Мы заботимся о каждом клиенте и хотим, чтобы вы остались довольны нашим сервисом!
Проверить ОСАГО — это сэкономить деньги!
Ни для кого не секрет, что в таком огромном мегаполисе, как Москва, легко попасть в руки мошенников, подрывающих авторитет порядочных страховщиков. Это могут быть неизвестные фирмы-однодневки или недобросовестные агенты, которые выдадут вам полис и даже не передадут информацию о нем в страховую компанию.
Это могут быть неизвестные фирмы-однодневки или недобросовестные агенты, которые выдадут вам полис и даже не передадут информацию о нем в страховую компанию.
Если не провести своевременную проверку полиса ОСАГО, такое мошенничество может обернуться огромными проблемами для автомобилистов, купивших поддельный документ. В случае аварии по такому полису оформление страховых выплат становится невозможным, и пострадавшие вынуждены самостоятельно возмещать ущерб.
Именно поэтому мы рекомендуем вам не пытаться сэкономить на покупке ОСАГО у сомнительного страховщика, а приобретать «автострахование» исключительно у надежных и уважаемых компаний, порядочность которых подтверждена годами успешной работы в России. магазин.Помните: вовремя чек ОСАГО — значит, обезопасить себя от потерь. Обратившись к нам, вы получаете возможность получить полис обязательного автострахования от лучших страховщиков России с полной гарантией качества.
Как проверить политику ОСАГО
Очень легко и доступно каждому понять, что вы получили полностью легальный и юридически оформленный страховой полис «Автогражданка». Ваше ОСАГО должно соответствовать следующим критериям:
Ваше ОСАГО должно соответствовать следующим критериям:
- ОСАГО ОГА: Обратившись к нам, вы гарантированно получите полис обязательного автострахования от ведущих страховщиков: РОСГОССТРАХ, РЕСО-ГАРАНТИЯ, УРАЛСИБ и других авторитетных организаций, зарегистрированных в реестре Союза автостраховщиков России.Мы официальные представители, и вы всегда можете проверить ОСАГО на подлинность и принадлежность страховой компании.
- Уникальный номер полиса: каждому юридически оформленному документу присваивается десятизначный персональный идентификационный номер, который заносится сразу в две официальные базы данных: Союза автостраховщиков России и самой страховой компании.
Подлинность ОСАГО ОГА может узнать каждый!
Используя эту информацию, вы легко можете убедиться, что полис ОСАГО, оформленный через нашу компанию, является полностью законным, а при наступлении страхового случая вам гарантирована выплата компенсации.
- Чек ОСАГО сразу при получении! После того, как наш агент передал вам готовый документ, вы сразу можете проверить его качество. Сделать это можно самостоятельно, либо с помощью специалиста. Для этого нужно зайти на сайт Союза автостраховщиков России, и поискать по официальной базе ОСАГО РГА. Если система подтвердила наличие номера вашего полиса в едином реестре — документ является абсолютно законным и имеет юридическую силу. После этого для максимальной уверенности рекомендуем сделать тестовый звонок в офис страховой компании и получить подтверждение того, что ваш полис включен в автоматизированную систему АИС ОСАГО.
- Проверка полиса ОСАГО перед доставкой: мы предоставляем уникальную услугу для наших клиентов. Вы можете быть уверены в высоком качестве услуг еще до того, как документ будет доставлен агентом. Не верите, что это возможно? Тогда закажите обратный звонок, и наши опытные специалисты проконсультируют вас по всем вопросам в ближайшие несколько минут!
Загляните в ОСАГО РГА прямо сейчас!
Мы ценим каждого клиента и заботимся о вашей надежной защите!
- Проверить действительность политики ОСАГО в Интернете
- Уточняйте, какой автомобиль застрахован по полису онлайн
- Проверить на автомобиле какой полис на него оформлен
На сегодняшний день база страховщиков СПС позволяет проверять страхование разными способами: по номеру полиса, по номеру автомобиля и т. Д.Всего существует три варианта проверки:
Вы можете проверить бумажный или электронный полис ОСАГО, используя базу данных РСС (Российский союз автостраховщиков), а срок его действия можно узнать ниже. Эта форма предназначена для проверки как оригинальных полисов, так и электронных электронных полисов серии XXX, приобретенных ОНЛАЙН! Электронный полис ОСАГО попадает в базу данных СПС сразу после регистрации, однако изредка из-за загруженности баз может появиться через 1-3 дня.Правильный статус для действующей страховки — «у страхователя» (однако, если сразу после приобретения статус по-прежнему «у страховой компании», то может быть — страховой агент не успевает внести изменения в базу данных , подождите пару дней и только потом бейте тревогу). Несомненно, поддельный полис можно декларировать, если он имеет статус «просрочен», «напечатан производителем» или «утерян». Статус «напечатан производителем» означает, что такая форма не подавалась страховой компанией.
Такая проверка никоим образом не дает 100% уверенности в том, что перед вами настоящий полис (поскольку у мошенников была возможность сделать «дубликат» настоящей формы), но можно выявить явные подделки и украденные бумаги. . Но чтобы исключить дубликаты полиса, нужно проверить, какой номер машины прописан в соответствии с вашей политикой …
кроме государственного номера, VIN-кода или номера тела, в результатах можно узнать наиболее подробный статус формы, например, почему страховка не работает конкретно (они могли преждевременно расторгнуть договор или страховой полис мог быть потерянным):
3.Узнать номер полиса по VIN или номеру тела + проверить сколько человек включено в страховкуЭто такая же проверка, как и предыдущая, только наоборот, здесь по данным автомобиля вы спрашиваете, в какой страховой компании вы застрахованы, номер полиса и его тип (с ограничением или без ограничений). Проверка VIN чрезвычайно тщательная. По гос номеру, только по каким данным ищется страховая компания (не всегда делают это вовремя).
В современных условиях, если вы хотите проверить подлинность политики ОСАГО или значение ОСАГО конкретного водителя, на первый план выходят различные варианты онлайн-проверки. Преимущества их использования очевидны и заключаются, прежде всего, в простоте и эффективности процедуры.
Проверка статуса полиса по его номеру
Самым простым и быстрым вариантом проверки страхового полиса является использование номеров этого документа … Для этого в соответствующей ячейке онлайн-сервиса, расположенной в окне ниже , необходимо ввести все 10 цифр, указанных в бланке страхового документа… Затем следует нажать кнопку «Поиск», после чего программа проверит данные о нем с тем, что указано в официальной базе данных PCA. По результату проверки вы узнаете статус и проверите подлинность документа у вас на руках, а также получите информацию о размере MSC.
Как узнать номер полиса?
Достаточно часто от владельца транспортного средства требуется проверить подлинность полиса, используя данные об автомобиле, который у него есть.К ним относятся VIN, номер кузова или государственный регистрационный номер транспортного средства.
Что делать, если проверить политику не удалось?
Часто программа онлайн-проверки выдает сообщение об отсутствии подтверждения существования политики в базе данных AIS PCA. В такой ситуации следует внимательно проверить введенные в сервис данные и повторно запустить проверку. В некоторых случаях причиной возникших проблем является ошибка сотрудников страховой компании, которые предоставили PCA неверную информацию.Чтобы исправить ситуацию, необходимо указать им на допущенные ошибки.
Сделать это можно двумя способами — через Интернет и путем визуального осмотра. Оба варианта не отнимут у вас много времени. Вы можете проверить это, не выходя из дома.
Через Интернет
Подлинность можно узнать онлайн. Для этого есть два основных ресурса — база Росгосстраха и сайт СПС (Российский союз автостраховщиков). Поговорим об этих методах подробнее.
В базе страховой компании
Каждый юридический документ имеет индивидуальный номер, состоящий из 10 цифр. Именно с его помощью проверяется политика. Его необходимо написать в соответствующем поле, и если документ официально зарегистрирован, сайт предоставит информацию об этом.
Использование веб-сайта PCA
Владелец автомобиля должен указать серию предлагаемых ему опций и номер договора. Кроме того, для проверки документа необходимо подтвердить код безопасности (ввести символы с картинки).
Если все сделано правильно, то в браузере откроется новое окно, где вся важная информация о политике.
Если документ действительный, то он должен иметь следующий статус: «В распоряжении страхователя». Также необходимо проверить соответствие срока страхования и названия страховой компании.
Иногда сразу после оформления страховки система отображает следующий статус документа: «Находится у страховщика.«Не беспокойтесь об этом. Скорее всего, информация еще не внесена в единую базу … Если полис был получен вами давно, но его статус не меняется, то вам необходимо обратиться в страховую. компании и выясните, в чем дело.
Есть еще такие статусы, как «Утерян» и «Недействителен». В этом случае стоит поволноваться, так как это говорит о том, что ваш полис недействителен. Для решения проблемы, обращайтесь не только в страховую компанию, но и в полицию.Однако, оказавшись в такой ситуации, владельцу транспортного средства все равно придется покупать новый полис.
Онлайн-проверка политики с помощью описанных выше сервисов позволяет выявлять поддельные документы, но не сможет защитить от дубликатов. Если мошенники продали вам полис с номером, который уже есть в базе данных, то система все равно покажет вам, что документ в данный момент находится в руках страхователя.
Узнать, так ли это на самом деле, будет не так-то просто, ведь условия страхования, как правило, также будут совпадать.В этом случае рекомендуется узнать, какая модель автомобиля была застрахована по данному полису.
После обработки вашего запроса на сайте отобразится следующая информация:
- номер автострахования;
- Номер VIN или номер кузова;
- наименование страховой компании, в которой заключен договор;
- статус документа.
Чтобы проверить политику, достаточно внимательно сверить данные в базе данных с информацией в ваших документах.
ВАЖНО! Если вам выдали дубликат полиса, то данные о транспортном средстве, на которое зарегистрирован документ, не будут совпадать.
Визуально
Политика CTP должна соответствовать определенным требованиям. Зная их, вы сможете отличить оригинал от подделки. Проверить не составит труда.
Чтобы убедиться, что этот документ перед вами, обратите внимание на следующие параметры:
- Длина заготовки должна быть 306-307 мм.Полис ОСАГО почти на 1 см длиннее обычного листа А4.
- На лицевой стороне документа вы можете увидеть синюю микросетку, но она также может иметь зеленоватый оттенок.
- При проверке водяных знаков на свету можно увидеть эмблемы PCA.
- На оборотной стороне должны быть доказательства в виде белой металлизированной полосы. Учесть это несложно. Она справа. Полоска имеет толщину около 2 мм.
- На всей поверхности полиса ОСАГО можно заметить пятна красного цвета, которые напоминают ворсинки.
- Подлинные документы печатаются качественными чернилами. Его не следует печатать на пальцах.
- Номер полиса, состоящий из 10 цифр, а также его серия, должны быть выдавлены на ощупь.
С 2018 года старомодные бланки с серией EEE Страховые компании не имеют права оформлять. С июля 2018 года актуальны серии ККК и МММ.
Ниже представлен новый образец страхового полиса ОСАГО:
Лицевая сторона
Нижняя сторона
Чем отличается настоящий полис от поддельного?
Оригинальные бланки, в отличие от фальшивых, выпускаются на Гознаке. Они состоят из двух листов. Листы полиса не должны отличаться друг от друга по цвету, насыщенности и яркости.
Отсутствие водяных знаков, размытость печати и другие недостатки должны насторожить автовладельца.
На практике мошенники в нашей стране зачастую не печатают полисы самостоятельно, а продают якобы подлинные документы тех компаний, которые уже разорились. Чтобы избежать неприятностей и не нарваться на мошенников, оформляйте страховку ОСАГО в проверенных организациях.
Также пусть вас не обманывает сниженная цена страховки. Напротив, это должно настораживать. Цена на полис ОСАГО одинакова во всех страховых организациях. Его изменение запрещено законом.
Не забудьте проверить список действующих страховых компаний. Если сегодня один из них считается лидером, то завтра он может разориться.
Что следует учитывать при проверке точности бумаги?
Пошаговая инструкция по номеру автомобиля
Если у вас на руках оригинальный полис ОСАГО, то система должна будет выдать следующую информацию:
- номер и серия действующего договора ОСАГО;
- наименование страховой компании, в которой выдан документ;
- данные о водителях, которые могут пользоваться застрахованным транспортным средством.
Заключение
Собираясь оформить полис ОСАГО, будьте предельно внимательны. Заключайте договор только с проверенной страховой компанией. Помните, скупой платит дважды. Не доверяйте объявлениям, предлагающим оформить страховку по сниженной цене. С мошенниками может столкнуться любой желающий. Если это случилось с вами, то немедленно обратитесь в полицию.
Как подать заявку на страхование
Политика в отношении файлов cookie и данных
Мы используем файлы cookie и другие связанные технологии, чтобы улучшить и адаптировать работу вашего веб-сайта.См. Нашу Политику в отношении файлов cookie и данных. Эта политика предоставляет информацию о том, как AAMI собирает и использует данные, связанные с вашей онлайн-активностью, и как вы можете сохранить анонимность.
AAI LIMITED TRADING AS AAMI
AAMI Страхование жилищного строительства и домашнего имущества, страхование арендодателя, страхование Strata, страхование автомобилей, страхование мотоциклов, страхование ОСАГО в Новом Южном Уэльсе и SA, страхование ACT MAI, страхование караванов, страхование бизнеса и страхование путешествий выдается AAI Limited ABN 48 005 297 807 AFSL 230859 (AAI), торгующийся как AAMI.Зарегистрированный офис, уровень 23, 80 Ann Street, Brisbane QLD 4000.
Представленная информация носит общий характер и подготовлена без учета конкретных целей, финансового положения или потребностей какого-либо лица. Прочтите соответствующее Заявление о раскрытии информации о продукте или Политический документ, доступные на сайте www.aami.com.au, и подумайте, подходит ли он вам, прежде чем принимать какие-либо решения о том, покупать или продолжать хранить продукт. Также доступно определение целевого рынка.
Этот контент актуален для полисов страхования домов, домашнего имущества, пожаров и краж, домовладельцев, стратов, автомобилей, домов на колесах и мотоциклов с датой начала действия после 14 декабря 2020 года.
AAMI PET INSURANCE
Petinsurance.com.au выдается The Hollard Insurance Company Pty Ltd ABN 78 090 584 473, AFSL 241436 (Hollard), организуется и управляется PetSure (Австралия) Pty Ltd ABN 95 075 949 923, AFSL 420183 (PetSure) и продвигается и распространяется Уполномоченными представителями PetSure (AR) Pet Insurance Pty Ltd ABN 38 607160 930, AR 1234944 (PIPL) и Platform Ventures Pty Ltd ABN 35 626745 177, AR 001266101 (Ventures) (под брендом AAMI). ).Любые предоставленные советы носят общий характер и не принимают во внимание ваши индивидуальные цели, финансовое положение или потребности. Перед покупкой ознакомьтесь с Заявлением о раскрытии информации о продукте, чтобы убедиться, что этот продукт соответствует вашим потребностям. Заявление о раскрытии информации о продукте и определение целевого рынка доступно по адресу www.aami.com.au/policy-documents. PIPL и авторизованные партнеры-дистрибьюторы PIPL (включая Ventures получат комиссию, которая представляет собой процент от премии, уплаченной Hollard, а PetSure может получить часть прибыли от андеррайтинга, если таковая имеется — обратитесь в PetSure для получения более подробной информации.
Портал документации платформы CipherTrust
Подписывание файлов проверяет подлинность и целостность исполняемых файлов и приложений, прежде чем им будет разрешен доступ к данным GuardPoint. Когда вы инициируете подпись файла в CipherTrust Manager, агент CTE вычисляет криптографические подписи исполняемых файлов, которые имеют право на доступ к данным GuardPoint. Файлы подписываются индивидуально как часть набора, и набор настраивается в политике, которая определяет разрешенные процессы.
Когда исполняемый файл пытается получить доступ к GuardPoint, служба secfs проверяет отпечаток пальца, дайджест сообщения SHA-2 (алгоритм безопасного хеширования) исполняемого файла по отпечатку пальца, хранящемуся в базе данных CTE. Если они совпадают, подлинность исполняемого файла проверяется, и ему может быть разрешен доступ к защищенным данным. Враждебному или скомпрометированному исполняемому файлу, например троянскому приложению, вредоносному программному коду или мошенническому процессу, с отсутствующей или несоответствующей подписью, будет отказано в доступе.
После создания набора файлов для подписи исполняемые файлы подписываются на выбранном клиенте, и копия каждой подписи сохраняется на CTE. Это выполняется в фоновом режиме на выбранном клиенте. Время, необходимое для завершения подписи, зависит от количества подписываемых файлов, времени отклика клиентской системы и других факторов нагрузки. Статус завершения отображается в окне «Наборы подписей».
Завершенные наборы подписей настраиваются в политике (CTE Agent), поэтому не только идентифицируются исполняемые файлы, пытающиеся получить доступ к GuardPoint, но и проверяются их подписи, чтобы гарантировать, что они не были скомпрометированы.
Процесс подписи
Основные этапы процесса подписания подписи:
Администратор сервера CTE создает наборы подписей. Подробности см. В разделе «Создание наборов подписей».
Администратор сервера CTE инициирует запрос подписи подписи. Администратор выбирает набор подписей для подписи и клиента CTE, который подпишет набор. Подробности см. В разделе «Подписание файлов в наборе подписей».
CipherTrust Manager пересылает запрос выбранному клиенту CTE.
Клиент CTE подписывает набор и отправляет его в CipherTrust Manager.
CipherTrust Manager:
Обновляет подписи в наборе.
Обновляет затронутые политики.
Отправляет обновленные файлы конфигурации, включая подписи, клиентам, использующим затронутые политики.
В будущем, если какие-либо процессы в наборе подписей будут обновлены, набор подписей должен быть подписан снова.Администратор сервера CTE может снова инициировать процесс подписания подписи. Это называется процессом повторного подписания подписи.
На следующей диаграмме показан процесс подписания подписи высокого уровня:
Использование наборов подписей в политике
Политики могут быть настроены для идентификации исполняемых файлов, пытающихся получить доступ к данным GuardPoint, и для проверки того, что сами исполняемые файлы не изменились, так как они были подписано. Однако вы должны предвидеть влияние шифрования на подписи файлов.
Когда файл внутри GuardPoint копируется в место за пределами GuardPoint, эти два файла имеют разные подписи. Файл в GuardPoint зашифрован, а файл вне GuardPoint — нет.
Шифрование делает два файла разными. Процесс VMD не расшифровывает защищенные файлы до проверки их подписей. Таким образом, когда вы изменяете ключи защищенных файлов, их подписи также меняются. Повторно подпишите файлы, которые используют подписи этих файлов в наборах процессов.
Если оба файла должны иметь доступ к данным GuardPoint, добавьте оба файла в набор подписей и подпишите их. Если шифрование не применяется, оба файла имеют одинаковую подпись; несоответствия подписи возникнуть не должно.
Создание наборов подписей
Набор подписей — это набор имен файлов и / или имен каталогов. Вы можете ввести полный путь к файлам и каталогам вручную или использовать браузер, чтобы найти и выбрать их. Укажите каталог для подписи всех файлов в этом каталоге и всех подкаталогов, которые он может содержать.
Подписание большого количества файлов может занять некоторое время. Чтобы сократить время обработки, убедитесь, что файлы и каталоги в наборе подписей существуют. Обработка несуществующих файлов занимает больше времени. Если они не существуют, рекомендуется удалить их как источники из набора сигнатур. Подробности см. В разделе «Удаление источника из наборов подписей».
Чтобы создать набор подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей .
Нажмите Создать набор подписей . Откроется мастер создания набора подписей.
На экране Общая информация :
Введите уникальное имя для набора.
Имя должно начинаться с символа. Максимальная длина может составлять 64 символа.
Имя может содержать буквенно-цифровые символы, символы подчеркивания (
_) и тире (–).& * <=> + () {} ~, \ / [] ‘»
Укажите описание для набора.
Нажмите Далее . Откроется экран добавления источников. На этом экране вы можете добавить файлы для подписи, как описано ниже.
Добавление файлов в набор подписей
Укажите путь к каталогу или файлу, который нужно подписать. Если каталог указан, все файлы в каталоге и его подкаталогах подписываются.
CipherTrust Manager предоставляет возможность добавления нескольких источников. Одновременно можно добавить не более 200 источников.
Нажмите Добавить источник .
Нажмите Выберите клиента . Отображается список зарегистрированных клиентов.
Выберите желаемого клиента.
Щелкните Выберите . Выбранный клиент появится рядом с кнопкой «Сменить клиента» (ранее «Выбрать клиента»).
При необходимости смените клиента, нажав Изменить клиента .
Укажите путь для подписи, набрав вручную или используя браузер.
Чтобы перейти к определенному каталогу, введите путь к каталогу в поле Начальный каталог и нажмите Применить . Браузер показывает подкаталоги и файлы, как показано ниже.
Вы не можете просматривать выше начального каталога. Введите начальную точку, которая находится выше в иерархии каталогов, чем все каталоги и файлы, которые вы хотите выбрать, или вам придется повторно ввести начальные точки, чтобы найти и выбрать нужные файлы.По умолчанию используется верхний уровень: косая черта (Linux) или обратная косая черта (Windows).
В качестве альтернативы, если вы знаете путь к каталогу, вы можете ввести его вручную в поле Путь .
Нажмите Добавить источник . Выбранный источник отображается в списке ВЫБРАННЫЕ ИСТОЧНИКИ.
При желании вы можете добавить новый источник, нажав Добавить источник . Чтобы удалить источник, нажмите Удалить справа от источника. Набор подписей должен содержать хотя бы один источник.
Нажмите Добавить . Выбранный источник отображается в списке Source Directory.
При желании вы можете добавить новый источник, нажав Добавить источник . Чтобы удалить источник, щелкните значок переполнения (), соответствующий источнику, и щелкните Удалить .
Нажмите Далее . На экране подтверждения отображается общая информация о наборе и выбранных источниках.
Проверьте установленные данные.Если сведения неверны или вы хотите их изменить, щелкните Назад и обновите сведения.
Нажмите Сохранить .
Вновь созданный набор появится на вкладке «Наборы подписей». По умолчанию набор подписей имеет статус UNSIGNED .
Перед применением политик к процессам рекомендуется подписать набор подписей. Это гарантирует, что измененный или скомпрометированный исполняемый файл процесса не получит разрешения на доступ к защищенным GuardPoints.Подробности см. В разделе «Подписание файлов в наборе подписей».
Подпись файлов в наборе подписей
Подпись включает вычисление хэш-значения для файла и сохранение этого значения в CipherTrust Manager. Позже, когда политика проверяет подписи, подпись процесса или исполняемого файла, обращающегося к GuardPoint, вычисляется и сравнивается со значением в CipherTrust Manager. Если два значения совпадают, процесс или исполняемый файл удовлетворяет требованиям политики политики и может получить доступ к защищенным данным.
Если сам исполняемый файл является нестабильным или подвержен частым изменениям, может быть нецелесообразно использовать подпись файла в качестве критерия в политике, потому что вам придется повторно подписывать исполняемый файл после каждого изменения. Если изменчивые исполняемые файлы являются членами большого набора подписей, повторная подпись файлов может занять некоторое время, поскольку подпись каждого файла в наборе подписей пересчитывается. Если изменчивых файлов мало, возможно, будет быстрее добавить изменчивые файлы в другой набор подписей и подписать этот набор, чем повторно подписывать все файлы в исходном наборе подписей.
Чтобы подписать файлы в наборе подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей . Отображается список настроенных наборов подписей.
Щелкните нужный набор подписей.
Выберите клиента, который будет подписывать набор подписей. Для запуска процесса подписи требуется подписывающий клиент.
На вкладке Source щелкните Select Client . Отображается список зарегистрированных клиентов. Выберите любого клиента, чтобы подписать набор подписей.
Выберите клиента.
Щелкните Выберите . Выбранный клиент появится рядом с кнопкой «Выбрать клиента». Значок «Знак» () теперь включен.
Не устанавливайте флажки при подписании набора подписей. Они используются для выбора исходных каталогов, которые необходимо удалить из набора.
Щелкните значок «Подписать» (). Процесс подписания начинается.
Статус подписи набора подписей становится InProgress .
Чтобы увидеть процент завершения процесса подписания, наведите указатель мыши на индикатор выполнения Spinner ().
Чтобы остановить процесс подписания до его завершения, щелкните значок «Остановить подпись» (). См. Подробности в разделе «Остановка процесса подписи».
Время завершения процесса подписи зависит от количества обрабатываемых файлов.Подписание происходит в фоновом режиме. Таким образом, вы можете использовать графический интерфейс CipherTrust Manager для других административных функций во время этого процесса.
Когда подписание завершено, статус подписи набора подписей становится Готово. См. «Проверка состояния завершения подписи» для получения подробной информации о состоянии подписи.
Полученные подписи доступны на вкладке Подпись набора подписей.
Проверка состояния завершения подписи
Чтобы просмотреть состояние завершения подписи набора подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей . Отображается список настроенных наборов подписей.
Просмотр статуса подписи для набора подписей. Статус подписи может быть:
Статус Описание Без знака Набор подписей беззнаковый. Либо в наборе нет файлов, либо еще не предпринимается попыток их подписать. InProgress CipherTrust Manager активно подписывает файлы в наборе. Это может занять некоторое время в зависимости от загрузки системы, доступности и количества одновременно подписываемых файлов. Завершено Все файлы в наборе успешно подписаны. Набор готов к использованию. FinishedWithWarning Все файлы в наборе обрабатываются, но один или несколько файлов в наборе не могут быть подписаны.Возможные причины — отсутствие файлов или недостаточные права доступа. Подробности смотрите в журналах VMD:
• В Unix vorvmd_root.log.
• В Windowsvorvmd.log. Также можно просмотреть журналы в средстве просмотра событий> CipherTrust Encryption Expert.
Дополнительные сведения см. В разделе «Проверка журналов агента при сбое подписи».Прервано Подписание было начато, но остановлено до завершения.
Остановка процесса подписи
Прервать процесс подписи в любое время до его завершения.Щелкните значок «Остановить подпись» () на вкладке «Источник» вкладки «Наборы подписей». CipherTrust Manager предлагает вам подтвердить свой выбор.
Процесс подписания останавливается через некоторое время. После остановки процесса состояние подписи, отображаемое на вкладке «Наборы подписей», устанавливается на прерывание. Все файлы, которые были подписаны до остановки процесса, остаются нетронутыми, и их можно просмотреть на вкладке «Подпись» набора подписей.
Отображение подписей файлов в наборе подписей
CipherTrust Manager предоставляет параметры для отображения подписей всех или определенных файлов в наборе подписей.
Отображение подписей всех файлов в наборе подписей
Чтобы отобразить подписи всех файлов в наборе подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей . Отображается список настроенных наборов подписей.
В разделе Имя щелкните нужный набор подписей.
Щелкните вкладку Подпись .
Отображается список всех файлов (программ) в наборе подписей с их подписями. По умолчанию отображается 10 записей на странице. Отрегулируйте разбиение на страницы, чтобы просмотреть больше записей.
Отображение определенных подписанных файлов в наборе подписей
Чтобы отобразить определенные подписанные файлы в наборе подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей . Отображается список настроенных наборов подписей.
В разделе Имя щелкните нужный набор подписей.
Щелкните вкладку Подпись . По умолчанию все подписанные файлы в наборе отображаются в алфавитно-цифровом порядке.
В поле Search введите строку, которая соответствует частичному или полному имени программы, подпись которой вы ищете.
При поиске регистр не учитывается. Отображаются все файлы, в именах которых есть строка.
Обнаружение повторяющихся файлов
Если содержимое файла не изменено, его подпись остается неизменной независимо от имени файла и его местоположения. При этом подпись всех копий файла остается прежней. Итак, чтобы определить дубликаты файла, отобразите файлы на основе их подписи. При поиске с использованием подписи рекомендуется вводить полную подпись.
Для обнаружения дубликатов файла:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей . Отображается список настроенных наборов подписей.
В разделе Имя щелкните набор подписей, в котором вы хотите обнаружить повторяющиеся файлы.
Щелкните вкладку Подпись .Отображаются подписи файлов в наборе.
Скопируйте подпись файла из столбца Подпись .
Вставьте подпись в поле поиска . Удалите лишнее пространство, если оно вставлено при вставке.
Обратите внимание на результат поиска.
Если отображается несколько записей, существуют дубликаты файла. Если отображается одна запись, дубликаты файла не существуют. Например, на следующем рисунке показаны два файла с разными именами и расположениями, но с идентичным содержимым в зависимости от их подписи.
Удаление подписей из наборов подписей
Удалите либо отдельные подписи из набора, либо полные наборы подписей. См. Удаление наборов подписей для получения информации об удалении полных наборов подписей.
Удалите подписи из набора подписей, если вы хотите продолжить использовать набор подписей для проверки подлинности процессов, но больше не хотите проверять подлинность файлов, которые вы удаляете из набора.
Вы можете удалять подписи по отдельности или по одной странице за раз.
Удаление одиночных подписей
Чтобы удалить одиночную подпись из набора подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей .
Щелкните нужный набор подписей.
Щелкните вкладку Подпись . Отображается список подписей в наборе подписей.
Щелкните значок переполнения (), соответствующий желаемой подписи.
Нажмите Удалить . Появится диалоговое окно, предлагающее подтвердить действие.
Нажмите Удалить .
Выбранная подпись удаляется из списка и базы данных CipherTrust Manager.
Удаление нескольких подписей
Чтобы удалить одну или несколько подписей из набора подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей .
Щелкните нужный набор подписей.
Щелкните вкладку Подпись .
Установите флажки, соответствующие подписям, которые нужно удалить.
Чтобы выбрать все подписи для удаления, установите верхний флажок слева от заголовка Подпись.
Щелкните значок удаления (). Появится диалоговое окно, предлагающее подтвердить действие.
Нажмите Удалить .
Выбранные подписи удаляются из списка и базы данных CipherTrust Manager.
Удаление источника из наборов подписей
Подписание многих файлов может занять некоторое время. Чтобы сократить время обработки, убедитесь, что файлы и каталоги в наборе подписей существуют. Обработка несуществующих файлов занимает больше времени.Если они не существуют, рекомендуется удалить их как источники из набора сигнатур.
Удаление отдельных источников
Чтобы удалить отдельный источник из набора сигнатур:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей .
Щелкните нужный набор подписей.На вкладке «Источник» отображается список исходных каталогов.
Щелкните значок переполнения (), соответствующий желаемому исходному каталогу.
Нажмите Удалить . Появится диалоговое окно, предлагающее подтвердить действие.
Нажмите Удалить .
Выбранный источник удаляется из списка и базы данных CipherTrust Manager.
Удаление нескольких источников
Чтобы удалить один или несколько источников из набора сигнатур:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей .
Щелкните нужный набор подписей. На вкладке «Источник» отображается список исходных каталогов.
Установите флажки, соответствующие нужным исходным каталогам.
Чтобы выбрать все источники для удаления, установите верхний флажок слева от заголовка Source Directory.
Щелкните значок удаления (). Появится диалоговое окно, предлагающее подтвердить действие.
Нажмите Удалить .
Выбранные источники удаляются из списка и базы данных CipherTrust Manager.
Удаление наборов подписей
Удаление отдельных подписей из набора или полных наборов подписей. См. Удаление подписей из наборов подписей для получения информации об удалении отдельных подписей.
Активный (используемый) набор подписей не может быть удален. Перед удалением набора подписей из CipherTrust Manager убедитесь, что никакие политики не используют его.
CipherTrust Manager предоставляет опции для удаления одного или нескольких наборов подписей.
Удаление наборов единой подписи
Чтобы удалить набор одиночных подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей . Отображается список настроенных наборов подписей.
Щелкните значок переполнения (), соответствующий желаемому набору подписи.
Нажмите Удалить . Появится диалоговое окно, предлагающее подтвердить действие.
Нажмите Удалить .
Выбранный набор подписей будет удален из списка.
Удаление нескольких наборов подписей
Чтобы удалить наборы одной или нескольких подписей:
Откройте приложение Transparent Encryption .
Щелкните Политики > Элементы политики .
Щелкните вкладку Наборы подписей . Отображается список настроенных наборов подписей.
Установите флажки, соответствующие нужным наборам подписей.
Чтобы выбрать все наборы для удаления, установите верхний флажок слева от столбца «Имя».
Щелкните значок удаления (). Появится диалоговое окно, предлагающее подтвердить действие.
Нажмите Удалить .
Выбранные наборы подписей удаляются из списка.
Повторная подпись файлов в наборе подписей
Подписи — это вычисленные значения. Если файлы в наборе подписей не скомпрометированы или не изменены, подпись для данного файла всегда остается той же. Если файлы изменены, их необходимо повторно подписать, чтобы их подписи совпадали с подписями в CipherTrust Manager.
Чтобы повторно подписать файлы, вы можете:
Создать и подписать новый набор подписей с файлами и каталогами, которые нужно подписать.Используйте эту опцию, если набор содержит только несколько файлов и каталогов.
Создайте и подпишите новый набор подписей, указав пути к каталогам, которые содержат файлы, которые нужно подписать. Используйте эту опцию, если каталоги содержат только несколько файлов или большинство файлов в каталогах требует повторной подписи.
Откройте и повторно подпишите существующий набор подписей, который изначально использовался для подписи файлов. Используйте эту опцию, если у вас есть время или набор подписей небольшой.
Вычисление подписи каждого файла в большом наборе подписей занимает много времени.
Повторная подпись файлов в наборе занимает больше времени, чем подписание файлов в первый раз. Для обновления информации в CipherTrust Manager требуется дополнительная обработка. Если вы планируете повторно подписать большое количество файлов (скажем, сотни тысяч), можно быстрее:
Удалить существующий набор подписей. См. Подробности в разделе «Удаление наборов подписей».
Снова создайте набор подписей с нуля. Подробности см. В разделе «Создание наборов подписей».
Еще раз подпишите файлы набора подписей. Подробности см. В разделе «Подписание файлов в наборе подписей».
Проверка журналов агента в случае сбоя подписи
В случае сбоя подписи или если вы хотите получить дополнительную информацию о процессе подписания, например о том, какие файлы были пропущены, проверьте журналы агента CTE, записанные на клиенте.
Сообщения регистрируются в:
(UNIX)
/var/log/vormetric/vorvmd_root.logс включенным журналом в файл и на сервере системного журнала с включенным системным журналом.(Windows)
\ Documents and Settings \ ... \ agent \ log \ vorvmd.logс включенным журналом регистрации в файл.
В файле vorvmd_root.log / vorvmd.log на клиенте найдите такие сообщения, как:
[VMD] [WARN] [3732] [VMD3824W] Не удалось создать подпись для E: \ apps \ lib \ dx1 \ aa_dir \ dataxform_auto_config для подписи запрос 9, код ошибки 3
В следующей таблице перечислены коды ошибок с их описанием:
| Код | Описание |
|---|---|
| 0 | Система в порядке. |
| 1 | Не существует. |
| 2 | НЕ ИСПОЛЬЗУЙТЕ. |
| 3 | Неверный аргумент. |
| 4 | Операция не поддерживается. |
| 5 | Недостаточно памяти. |
| 6 | На устройстве не осталось места. |
| 7 | Истекло время ожидания. |
| 8 | Ошибка ввода-вывода. |
| 9 | Прервано. |
| 10 | В разрешении отказано. |
| 11 | Слишком много ключей в группе ключей. |
| 12 | Ошибка в RPC-слое мыла. |
| 13 | Возвращенный буфер частично заполнен. |
| 14 | Заданный целевой буфер слишком мал. |
| 15 | Невозможно сжать буфер. |
| 16 | Не удалось выполнить внутренний тест. |
| 17 | Переполнение. |
| 18 | Ошибка при настройке ведения журнала. |
| 19 | Ошибка перегрузки. |
| 20 | Сервер ответил на загрузку файла «неверным запросом». |
| 21 | Неизвестное имя пользователя или неверный пароль. |
| 22 | Служба каталогов недоступна. |
Как преобразовать лицензию иностранного пилота в соответствие с требованиями FAA
Многие иностранные студенты, которые уже получили лицензию пилота в своих странах, прежде чем перейти в Epic для продолжения обучения в качестве коммерческого пилота.Эти студенты должны заполнить форму подтверждения подлинности иностранной лицензии и медицинского свидетельства, как того требует Федеральное управление гражданской авиации, чтобы продолжить обучение в Epic. Независимо от объема обучения, полученного за пределами США, студенты могут перейти только на максимальное количество частных пилотов FAA. Процесс проверки иностранной лицензии может занять до 90 дней, поэтому учащимся необходимо заранее планировать, проявлять инициативу и предоставлять необходимую документацию до прибытия в Epic.
Примечание. Если у вас есть какие-либо ограничения на вашу лицензию, немедленно сообщите об этом Допуску до начала процесса преобразования лицензии.
Отправьте форму подтверждения и иностранные документы в FAA
1) Заполните форму FAA 8060-71 (Подтверждение подлинности иностранной лицензии и формы медицинского свидетельства)
2) Сделайте увеличенную копию лицензии частного пилота
3) Сделайте увеличенную копию медицинского свидетельства
4) Отправьте форму и документы в FAA
Отправьте по почте заполненную форму FAA 8060-71, увеличенную копию лицензии частного пилота и увеличенную копию медицинской справки по адресу:
Отдел.транспорта / FAA
Отдел сертификации пилотов
PO Box 25504
Oklahoma City, OK 73125-0082
-OR-
Отправьте подписанный пакет заявления по адресу: [email protected]
ПРИМЕЧАНИЕ: Если любой из документы неразборчивы, FAA остановит процесс и свяжется со студентом по электронной почте для повторной подачи четких документов в течение 30 дней. Если студент не отвечает, запрос на преобразование иностранной лицензии отменяется.
Подтвердите запрос проверки в вашем ведомстве гражданской авиации
Позвоните в управление гражданской авиации вашей страны, чтобы убедиться, что запрос был получен и обработан.Если ваша страна не ответит на запрос FAA о проверке, FAA будет повторно отправлять запрос каждые 30 дней до 4 раз. Если проверка не будет завершена, запрос будет отменен.
Получить письмо о подлинности и получить медицинское свидетельство FAA
В случае одобрения студент получит письмо о подлинности от FAA, которое дает ему право на получение временного сертификата. Затем студент должен пройти медицинское обследование, которое дает право на получение медицинского сертификата FAA по прибытии сюда, в США.S.
Прибытие в Epic и завершение регистрации в IACRA
- Зарегистрируйтесь в IACRA, используя точное имя , указанное в Письме о подлинности, которое должно соответствовать вашему паспорту. Примечание. Если срок действия вашего иностранного медицинского учреждения истек или имя, указанное в письме о подлинности, не соответствует вашему паспорту, НЕ ИСПОЛЬЗУЙТЕ IACRA. Вам нужно будет использовать ACRA, программу на жестком диске, расположенном в тестовой комнате Epic.
- Выполните все 6 шагов на IACRA.
- На шаге 6 «Соло» означает единоличное лицо, находящееся в воздушном судне, а «PIC» означает индивидуальный плюс все остальное время PIC.
Получить сертификат пилота США
Студенты могут бесплатно получить временный сертификат в Orlando MCO FSDO. В качестве альтернативы учащиеся также могут встретиться с Филлис, чтобы назначить утвержденного экзаменатора (DE), который приедет прямо в школу и создаст временный сертификат (плата в размере 150 долларов США, только наличными). Независимо от своего выбора, студенты должны предоставить следующие документы:
- Зачисление в IACRA
- Подтверждение подлинности FAA
- 2 копии паспорта
- 2 копии лицензии иностранного пилота
- 2 копии медицинского сертификата FAA
- Журнал лётного журнала
*** ПРИМЕЧАНИЕ: Сертификат подлинности действителен только в течение 6 месяцев .Если студент должен оставаться более 6 месяцев, он должен повторно подать заявление за 2 месяца до истечения срока его действия. Многие студенты забывают эту информацию и не могут пройти контрольную, потому что срок действия их письма о подлинности истек. Если возникает необходимость повторно подать заявку на получение письма о подлинности, этот же процесс необходимо повторить, однако мы обнаруживаем, что во второй раз это происходит быстрее.
Чтобы напрямую связаться с отделом сертификации пилотов FAA для получения статуса подтверждения, студенты могут позвонить по телефону: + 1405-954-3261.Не стесняйтесь обращаться к нашей приемной комиссии Epic, если у вас есть какие-либо вопросы!
Хотите узнать больше об Epic Flight Academy? Свяжитесь с нами прямо сейчас! Мы здесь, чтобы ответить на любые вопросы и помочь вам начать работу!
Анкета качества дородовой помощи: разработка и тестирование инструментов | BMC по беременности и родам
Александр Г.Р., Котельчук М: Оценка роли и эффективности дородовой помощи: история, проблемы и направления будущих исследований.Представитель общественного здравоохранения 2001, 116 (4): 306-316.
CAS Статья PubMed PubMed Central Google ученый
Лу М.К., Таш В., Александр Г.Р., Котельчук М., Хальфон Н.: Предотвращение низкой массы тела при рождении: дородовой уход — ответ ?. J Matern Fetal Neonatal Med. 2003, 13 (6): 362-380.
CAS Статья PubMed Google ученый
Moos MK: Дородовая помощь: ограничения и возможности.J Obstet Gynecol Neonatal Nurs. 2006, 35 (2): 278-285.
Артикул PubMed Google ученый
Heaman MI, Newburn-Cook CV, Green CG, Elliott LJ, Helewa ME: Неадекватный дородовой уход и его связь с неблагоприятными исходами беременности: сравнение показателей. BMC Беременность и роды. 2008, 8: 15-
Статья PubMed PubMed Central Google ученый
VanderWeele TJ, Lantos JD, Siddique J, Lauderdale DS: Сравнение четырех индексов пренатальной помощи в моделях исходов родов: сопоставимые результаты для прогнозирования исходов малых для гестационного возраста, но разные результаты для преждевременных родов или младенческой смертности. J Clin Epidemiol. 2009, 62 (4): 438-445.
Артикул PubMed Google ученый
Партридж С., Балайла Дж., Холкрофт Калифорния, Абенхайм Х.А.: Неадекватное использование дородовой помощи и риски младенческой смертности и неблагоприятных исходов родов: ретроспективный анализ 28 729 765 U.С. поставки более 8 лет. Am J Perinatol. 2012, 29 (10): 787-794.
Артикул PubMed Google ученый
Коренброт С.К., Вонг С.Т., Стюарт А.Л.: Услуги по укреплению здоровья и психосоциальные услуги и оценка женщин межличностного дородового ухода в рамках управляемой медицинской помощи Medicaid. Matern Child Health J. 2005, 9 (2): 135-149.
Артикул PubMed Google ученый
Beeckman K, Louckx F, Masuy-Stroobant G, Downe S, Putman K: Разработка и применение нового инструмента для оценки адекватности содержания и сроков дородовой помощи. BMC Health Serv Res. 2011, 11: 213-
Статья PubMed PubMed Central Google ученый
Коган М.Д., Александр Г.Р., Котельчук М., Надей Д.А.: Связь содержания дородовой помощи с риском низкой массы тела при рождении. Отчеты матерей с рекомендациями по поведению в отношении здоровья и первичными процедурами дородового ухода.ДЖАМА. 1994, 271 (17): 1340-1345.
CAS Статья PubMed Google ученый
White DE, Fraser-Lee NJ, Tough S, Newburn-Cook CV: содержание дородовой помощи и ее связь с преждевременными родами в Альберте. Canada Health Care Women Int. 2006, 27 (9): 777-792.
Артикул PubMed Google ученый
Хендлер А., Рэнкин К., Розенберг Д., Синха К.: Степень документированного соблюдения рекомендованного содержания дородовой помощи: различия между поставщиками медицинских услуг и влияние на результаты среди женщин с низким доходом.Matern Child Health J. 2012, 16 (2): 393-405.
Артикул PubMed Google ученый
Klerman LV, Ramey SL, Goldenberg RL, Marbury S, Hou J, Cliver SP: рандомизированное испытание расширенного дородового ухода для афроамериканок с множественным риском, отвечающих критериям Medicaid. Am J Public Health. 2001, 91 (1): 105-111.
CAS Статья PubMed PubMed Central Google ученый
Рикеттс С.А., Мюррей Е.К., Швальберг Р.: Снижение низкой массы тела при рождении путем устранения рисков: результаты программы «Пренатальный плюс» в Колорадо. Am J Public Health. 2005, 95 (11): 1952–1957.
Артикул PubMed PubMed Central Google ученый
Карлсон Н.С., Лоу Н.К.: Центрирование беременности: новый подход в дородовой помощи. MCN Am J Matern Child Nurs. 2006, 31 (4): 218-223.
Артикул PubMed Google ученый
Уилкинсон Д.С., Коренброт С.К., Грин Дж .: Показатель эффективности психосоциальных услуг в рамках расширенного дородового ухода за женщинами, имеющими право на участие в программе Medicaid. Matern Child Health J. 1998, 2 (3): 131-143.
CAS Статья PubMed Google ученый
Руис-Миразо Э., Лопес-Ярто М., Макдональд С.Д .: Групповая дородовая помощь по сравнению с индивидуальной дородовой помощью: систематический обзор и метаанализы. J Obstet Gynaecol Can. 2012, 34 (3): 223-229.
Артикул PubMed Google ученый
Goberna-Tricas J, Banus-Gimenez MR, Palacio-Tauste A, Linares-Sancho S: Удовлетворенность услугами по беременности и родам: качество услуг по охране материнства с точки зрения женщин. Акушерство. 2011, 27 (6): e231-e237.
Артикул PubMed Google ученый
Уитли Р.Р., Келли М.А., Пикок Н., Дельгадо Дж .: Рассказы женщин о качестве дородовой помощи: мультикультурная перспектива.Qual Health Res. 2008, 18 (11): 1586-1598.
Артикул PubMed Google ученый
Хильдингссон И., Томас Дж. Э .: Взгляд женщин на услуги по охране материнства в Швеции: процессы, проблемы и решения. J Здоровье женщин акушерства. 2007, 52 (2): 126-133.
Артикул PubMed Google ученый
Ваузе С., Мареш М.: Показатели качества дородовой помощи: пилотное исследование.Br J Obstet Gynaecol. 1999, 106 (3): 197-205.
CAS Статья PubMed Google ученый
Боллер К., Висс К., Мтасива Д., Таннер М.: Качество и сравнение дородовой помощи в государственных и частных поставщиках в Объединенной Республике Танзания. Bull World Health Organ. 2003, 81 (2): 116-122.
PubMed PubMed Central Google ученый
Вонг С.Т., Коренброт С.К., Стюарт А.Л.: Потребительская оценка качества межличностных процессов дородовой помощи среди этнически разнородных женщин с низкими доходами: разработка новой меры.Проблемы женского здоровья. 2004, 14 (4): 118-129.
Артикул PubMed Google ученый
Винагре М.Х., Невес Дж .: Влияние качества обслуживания и эмоций пациентов на удовлетворенность. Int J Health Care Qual Assur. 2008, 21 (1): 87-103.
Артикул PubMed Google ученый
Готлиб Дж. Б., Гревал Д., Браун С. В.: Удовлетворенность потребителей и воспринимаемое качество: дополнительные или расходящиеся конструкции ?.J Appl Psychol. 1994, 79 (6): 875-
Статья Google ученый
Хендлер А., Розенберг Д., Раубе К., Лион С. Характеристики дородового ухода и удовлетворенность афроамериканских женщин уходом в организации регулируемого медицинского обслуживания. Проблемы женского здоровья. 2003, 13 (3): 93-103.
Артикул PubMed Google ученый
Лоуренс Дж. М., Эршофф Д., Мендес С., Петитти Д. Б.: Удовлетворенность беременностью и уходом за новорожденным: разработка и результаты обследования в организации по поддержанию здоровья.Am J Manag Care. 1999, 5 (11): 1407-1413.
CAS PubMed Google ученый
Омар М.А., Шиффман Р.Ф., Бингхэм Р.Р .: Разработка и проверка ожиданий и удовлетворенности пациентов с помощью инструмента для дородовой помощи. Рес Нурс Здоровье. 2001, 24 (3): 218-229.
CAS Статья PubMed Google ученый
Клемент С., Сикорски Дж., Уилсон Дж., Дас С., Смитон Н.: Удовлетворенность женщин традиционным и сокращенным расписанием дородовых посещений.Акушерство. 1996, 12 (3): 120-128.
CAS Статья PubMed Google ученый
Seguin L, Therrien R, Champagne F, Larouche D: компоненты удовлетворенности женщин уходом за беременными. Рождение. 1989, 16 (3): 109-113.
CAS Статья PubMed Google ученый
Эрчи Б., Иванов Л.: Взаимосвязь между удовлетворенностью женщин услугами по дородовой помощи и характеристиками беременных женщин и услугами.Eur J Contracept Reprod Health Care. 2004, 9 (1): 16-28.
CAS Статья PubMed Google ученый
Иванов Л.Л., Флинн BC: Использование и удовлетворенность услугами по дородовой помощи. West J Nurs Res. 1999, 21 (3): 372-386.
CAS Статья PubMed Google ученый
Иванов Л.Л., Чемпион В.Л.: Развитие российской шкалы удовлетворенности дородовой помощью.J Nurs Meas. 2000, 8 (2): 117-129.
CAS PubMed Google ученый
Донабедян А: Оценка качества медицинской помощи. Milbank Mem Fund Q.1966, 44 (Приложение 3): 206-
Google ученый
Donabedian A: Качество обслуживания. Как это можно оценить ?. ДЖАМА. 1988, 260 (12): 1743-1748.
CAS Статья PubMed Google ученый
Адай Л.А., Андерсен Р.: Схема исследования доступа к медицинской помощи. Health Serv Res. 1974, 9 (3): 208-220.
CAS PubMed PubMed Central Google ученый
Андерсен РМ: Пересмотр поведенческой модели и доступ к медицинской помощи: имеет ли это значение ?. J Health Soc Behav. 1995, 36 (1): 1-10.
CAS Статья PubMed Google ученый
Кэмпбелл С.М., Роланд Миссури, Буетоу С.А.: Определение качества медицинской помощи. Soc Sci Med. 2000, 51 (11): 1611-1625.
CAS Статья PubMed Google ученый
Беннетт И., Свитцер Дж., Агирре А., Эванс К., Барг Ф .: «Разрушение»: общение между пациентом и врачом и дородовой уход среди афроамериканских женщин с низкой и высокой грамотностью. Ann Fam Med. 2006, 4 (4): 334-340.
Артикул PubMed PubMed Central Google ученый
Мур М.Л., Кетнер М., Уолш К., Ваггонер С.: Прослушивание женщин из группы риска преждевременных родов. MCN Am J Matern Child Nurs. 2004, 29 (6): 391-397.
Артикул PubMed Google ученый
Тандон С.Д., Парилло К.М., Кифер М: Восприятие латиноамериканскими женщинами ориентированности на пациента во время дородовой помощи: смешанный метод. Перинатальный уход при родах. 2005, 32 (4): 312-317.
Артикул Google ученый
Bloom KC, Bednarzyk MS, Devitt DL, Renault RA, Teaman V, Van Loock DM: Препятствия для дородового ухода за бездомными беременными женщинами. J Obstet Gynecol Neonatal Nurs. 2004, 33 (4): 428-435.
Артикул PubMed Google ученый
Sword W: Использование дородового ухода среди женщин с низким доходом: вопрос «заботы о себе». Qual Health Res. 2003, 13 (3): 319-332.
Артикул PubMed Google ученый
Chew-Graham CA, Sharp D, Chamberlain E, Folkes L, Turner KM: Раскрытие симптомов послеродовой депрессии, перспективы медицинских работников и женщин: качественное исследование. BMC Fam Pract. 2009, 10: 7-
Статья PubMed PubMed Central Google ученый
Аль-Кутоб Р., Мавайдех С., Бин Р.Ф .: Оценка услуг в области репродуктивного здоровья: концептуальная основа дородовой помощи. Health Care Women Int.1996, 17 (5): 423-434.
CAS PubMed Google ученый
Langer A, Nigenda G, Romero M, Rojas G, Kuchaisit C, Al-Osimi M, для Группы исследований ВОЗ по дородовой помощи: Концептуальные основы и методология оценки восприятия женщинами и поставщиками медицинских услуг качество дородовой помощи в рандомизированном контролируемом исследовании ВОЗ по антенатальной помощи. Педиатр Перинат Эпидемиол. 1998, 12 (Дополнение 2): 98-115.
Артикул PubMed Google ученый
Streiner DL, Norman GR: Шкалы измерения здоровья: практическое руководство по их разработке и использованию. 2003, Оксфорд: Издательство Оксфордского университета, 3
Google ученый
Петт М.А., Лаки Н.Р., Салливан Дж .: Осмысление факторного анализа: использование факторного анализа для разработки инструментов в исследованиях здравоохранения. 2003, Thousand Oaks, CA: Sage Publications
Книга Google ученый
Sword W, Heaman MI, Brooks S, Tough S, Janssen PA, Young D, Kingston D, Helewa ME, Akhtar-Danesh N, Hutton E: Взгляд женщин и поставщиков медицинских услуг на качественный пренатальный уход: качественное описательное исследование. BMC Беременность и роды. 2012, 12: 29-
Статья PubMed PubMed Central Google ученый
Файнштейн А.Р.: Клиниметрия. 1987, Нью-Хейвен: Нью-Хейвен: издательство Йельского университета
Google ученый
Маркс Р., Бомбардье С., Хогг-Джонсон С., Райт Дж. Г.: Клинические и психометрические стратегии для разработки шкалы измерения здоровья. J Clin Epidemiol. 1999, 52 (2): 105-111.
CAS Статья PubMed Google ученый
Диллман Д.А., Смит Дж. Д., Кристиан Л.М.: Интернет, почта и смешанные опросы: индивидуальный метод проектирования. 2009, Хобокен, штат Нью-Джерси: John Wiley & Sons Inc, 3
Google ученый
Waltz CF, Strickland OL, Lenz ER: Измерение в медицинских исследованиях. 2005, Нью-Йорк: Нью-Йорк: Springer Pub
Google ученый
ДеВеллис РФ: Развитие шкалы: теория и приложения. 2003, Таузенд-Окс, Калифорния: Sage Publications, Inc.
Google ученый
Комри А.Л., Ли Х.Б .: Первый курс факторного анализа. 1992, Хиллсдейл, Нью-Джерси: Лоуренс Эрлбаум, 2
Google ученый
Pedhazur EJ, Schmelkin LP: Измерение, проектирование и анализ: комплексный подход. 1991, Хиллсдейл, Нью-Джерси: Lawrence Erlbaum Associates
Google ученый
Strickland OL: Использование факторного анализа для оценки достоверности: практические соображения. J Nurs Meas. 2003, 11 (3): 203-205.
Артикул PubMed Google ученый
Мишель М.Х .: Методические исследования: разработка инструмента.Передовые разработки в исследованиях в области сестринского дела. Под редакцией: Brink PJ, Wood MJ. 1998, Thousand Oaks, CA: Sage Publications, 235-282. 2
Глава Google ученый
Полит Д.Ф., Бек К.Ф.: Медсестринские исследования: принципы и методы. 2004, Филадельфия: Липпинкотт Уильямс и Уилкинс, 8
Google ученый
Наннелли Дж. К., Бернштейн И. Х .: Психометрическая теория. 1994, Нью-Йорк: Макгроу-Хилл, 3
Google ученый
Вальтер С.Д., Элиашив М., Доннер А: Размер выборки и оптимальные планы для исследований надежности. Stat Med. 1998, 17 (1): 101-110.
CAS Статья PubMed Google ученый
Целевая группа профилактических услуг США: определения классов целевой группы профилактических услуг США. 2012 г., http://www.uspreventiveservicestaskforce.org/uspstf/grades.htm,
Google ученый
Донабедян A: Личфилдская лекция. Обеспечение качества в здравоохранении: роль потребителей. Качественное здравоохранение. 1992, 1 (4): 247-251.
CAS Статья PubMed PubMed Central Google ученый
Lees C: Измерение впечатлений пациентов. Медсестра Рес. 2011, 19 (1): 25-28.
Артикул PubMed Google ученый
Новик G: Женский опыт дородовой помощи: комплексный обзор.J Здоровье женщин акушерства. 2009, 54 (3): 226-237.
Артикул PubMed PubMed Central Google ученый
Хеман М., О’Брайен Б.: Специалист по дородовой помощи. Что говорят матери: канадское исследование материнства. Под редакцией: Агентство общественного здравоохранения Канады. 2009 г., Оттава: Агентство общественного здравоохранения Канады, 37–41.
Google ученый
Tough SC, Johnston DW, Siever JE, Jorgenson G, Slocombe L, Lane C, Clarke M: Улучшает ли дополнительный дородовой уход и помощь на дому использование ресурсов в универсальной системе здравоохранения? Рандомизированное контролируемое исследование в Канаде.Перинатальный уход при родах. 2006, 33 (3): 183-194.
Артикул Google ученый
Carifio J, Perla R: Десять распространенных недоразумений, заблуждений, устойчивых мифов и городских легенд о шкалах Лайкерта и форматах ответов Лайкерта и их противоядиях. J Soc Sci. 2007, 3 (3): 106-116.
Google ученый
Карифио Дж., Перла Р. Разрешение 50-летней дискуссии об использовании и неправильном использовании весов Лайкерта.Med Educ. 2008, 42: 1150-1151.
Артикул PubMed Google ученый
Розенберг К.Д .: Преимущества и ограничения дородового ухода. ДЖАМА. 1998, 280 (24): 2072-
CAS PubMed Google ученый
Границы | С-концевое аминирование катионного противовоспалительного пептида улучшает биодоступность и ингибиторную активность против воспаления, индуцированного ЛПС
Введение
Липополисахарид (ЛПС), основной компонент клеточной стенки грамотрицательных бактерий, считается основным причина воспаления (1, 2).Неконтролируемый LPS-ответ вызывает чрезмерное локализованное воспаление, такое как воспаление печени (3), и тяжелые системные реакции на инфекцию, такие как сепсис (4). Следовательно, контроль и удаление LPS имеют решающее значение для предотвращения чрезмерного воспаления и повреждения органов. Традиционно антибиотики, такие как полимиксин B, имеют терапевтическое значение для лечения воспаления, вызванного ЛПС (5). К сожалению, разработка полимиксина B в качестве противовоспалительного препарата столкнулась с рядом препятствий, в первую очередь связанных с нежелательными побочными эффектами, такими как нейро- и нефротоксичность, препятствующие их клиническому развитию (5).Следовательно, существует острая необходимость в идентификации и разработке новых лекарств, которые обладают улучшенными фармацевтическими профилями и уменьшенными побочными эффектами.
В последние годы некоторые нативные биоактивные пептиды были предложены в качестве многообещающей стратегии для разработки новых противовоспалительных средств (6–8). Большое количество организмов, таких как млекопитающие, насекомые, рыбы, земноводные и растения, выделяют пептиды как важные иммуномодуляторы (9). Сообщалось, что многие нативные пептиды обладают определенной ингибирующей активностью против LPS-индуцированного воспаления, например, LL-37 (10–13), кателицидин 2 (CATh3) (14) и тимопентин (TP5) (15, 16).Среди них CATh3 и TP5 продемонстрировали огромный потенциал в лечении LPS-индуцированного воспаления (14–16).
CATh3 представляет собой высококатионный (11 + ) пептид, полученный из гетерофилов кур. Сообщалось, что он оказывает сильное противовоспалительное действие за счет нейтрализации LPS (14) и регулирования экспрессии мРНК провоспалительных цитокинов, включая IL-1β, IL-6 и TNF-α (14). Следовательно, DEFB126 может предотвращать или ослаблять LPS-индуцированное воспаление.
TP5, фрагмент Arg32-Tyr36, полученный из тимопоэтина, проявляет свой противовоспалительный эффект за счет ингибирования сигнальных каскадов фактора транскрипции NF-κB и p38 (15-19).Кроме того, TP5 играет важную роль в созревании и дифференцировке Т-лимфоцитов, регулируя тем самым иммунитет и воспалительную реакцию (20, 21). В целом TP5 используется при лечении воспалительных заболеваний, таких как инфекционные заболевания, из-за его противовоспалительной активности и низкой цитотоксичности.
Однако развитие CATh3 было ослаблено его потенциальной цитотоксичностью (22). TP5 имеет минимальную цитотоксичность, но его развитие ослаблено из-за короткого периода полувыведения, что снижает его эффективность и биодоступность (23, 24).В качестве простой и эффективной стратегии, которая может сочетать преимущества различных нативных пептидов (25, 26), гибридизация была предложена для улучшения противовоспалительной активности и физиологической стабильности и снижения нежелательных цитотоксических эффектов этих нативных пептидов (25). Как сообщалось ранее, CATh3 (1–13) (14) проявляет сильную противовоспалительную активность. Таким образом, чтобы получить новый пептид с повышенной противовоспалительной активностью, но с минимальной цитотоксичностью, мы разработали гибридный пептид (CATh3-TP5, CTP) путем объединения активного центра CATh3 [CATh3 (1–13)] с TP5.Новый разработанный пептид, CTP, эффективно ингибировал LPS-индуцированное воспаление. Однако CTP подавляет LPS-индуцированный воспалительный ответ только тогда, когда он взаимодействует с LPS, но практически не ослабляет установленное LPS-стимулированное воспаление, которое, как предполагалось, является результатом плохого клеточного поглощения.
Чтобы преодолеть трудности доступа пептидов и проникновения в клетку, были использованы различные методы. Например, введение остатков гистидина (27, 28) или добавление D-аминокислот (29, 30) может усилить трансмембранную доставку пептида.Кроме того, гидрофобность пептидов требуется для повышенного поглощения клетками (31, 32), а C-концевое амидирование, как сообщается, увеличивает гидрофобность пептидов (33). Поэтому мы попытались модифицировать CTP для получения С-концевого амидированного производного пептида (CTP-NH 2 ) для улучшения клеточного поглощения, внутриклеточного распределения и, следовательно, противовоспалительной активности. Гидрофобность пептида характеризовали временем удерживания. In vitro. Были проведены эксперименты для оценки цитотоксичности, противовоспалительного эффекта и противовоспалительного механизма производного пептида.Кроме того, его противовоспалительные эффекты оценивались на мышиной модели сепсиса, индуцированной ЛПС.
Материалы и методы
Дизайн гибридного пептида
Гибридный пептид CATh3-TP5 (CTP, RWGRFLRKIRRFRRKDVY) был сконструирован путем объединения активного центра CATh3 (RWGRFLRKIRRFRPKVTITIQGSARF) с TP5. Первичный анализ последовательностей всех пептидов проводили с использованием ExPASy Proteomics Server: http://www.expasy.org/tools/protparam.html.
Синтез пептидов
Пептиды CATh3, TP5 и CTP были синтезированы в форме свободной C-концевой кислоты, а CTP-NH 2 синтезировали в форме амидированной C-концевой кислоты.Пептиды были синтезированы и очищены компанией KangLong Biochemistry (Цзянсу, Китай). Чистоту пептидов определяли с помощью ВЭЖХ и масс-спектрометрии (МС). Все пептиды имели чистоту 95% или выше. Пептиды растворяли в воде, свободной от эндотоксинов, и хранили при -80 ° C.
Время удерживания пептидов
Сообщалось, что время удерживания пептидов на матрице с обращенной фазой связано с гидрофобностью пептидов (34). Таким образом, относительная гидрофобность гибридных пептидов в водном растворе указывает на то, что различия в гидрофобности надежно отражаются разным временем удерживания при ВЭЖХ.
Клеточная культура
Клетки макрофагов мыши (RAW264.7) культивировали в среде Игла, модифицированной Дульбекко (DMEM) (HyClone, Logan, UT, USA), содержащей 10% (об. / Об.) Фетальной бычьей сыворотки (FBS) (Gibco, Фостер, Калифорния, США) и 1% (об. / Об.) Пенициллин / стрептомицин (HyClone) при 37 ° C во влажной атмосфере (5% CO 2 , 95% воздуха).
Анализ жизнеспособности клеток
Жизнеспособность обработанных пептидом клеток RAW264.7 определяли с использованием набора для подсчета клеток-8 (CCK-8) Assay Kit (Dojindo) (35).Клетки RAW264.7 высевали в 96-луночные планшеты при плотности 3 × 10 4 клеток / мл в 100 мкл DMEM в течение ночи. Затем в среду для культивирования клеток добавляли свежую среду, содержащую пептиды-кандидаты в серии концентраций, и планшеты инкубировали еще 24 или 72 часа. Каждую лунку инкубировали с 10 мкл раствора CCK-8 в течение 4 ч в темноте. После этого измеряли оптическую плотность при 450 нм с помощью считывающего устройства для микропланшетов. Жизнеспособность клеток определяли по формуле:
Жизнеспособность клеток (%) = (OD450sampleOD450 (контроль)) × 100%Противовоспалительный анализ в RAW264.7 Клеточная линия
RAW264.7 Клетки обрабатывали 10 мкг / мл пептидов или без них в течение 30 мин перед добавлением 100 нг / мл ЛПС ( E. coli , O55: B5, Sigma-Aldrich, Германия) и далее. инкубация в течение 12 ч при 37 ° C. После обработки оценивали концентрации TNF-α, IL-6 и IL-1β в супернатантах клеток.
Чтобы определить механизмы, лежащие в основе противовоспалительных эффектов, были выполнены три различных типа лечения, как показано ниже.
Предварительная обработка пептида
Вкратце, 10 мкг / мл пептида добавляли в среду для культивирования клеток и инкубировали с клетками в течение 1 ч при 37 ° C. После этого RAW 264.7 клеток промывали PBS и культивировали со свежей средой, содержащей 100 нг / мл LPS, в течение 12 ч при 37 ° C. После обработки оценивали секрецию TNF-α, IL-6 и IL-1β в клеточных супернатантах.
Пептид-нейтрализованный LPS
Пептиды (10 мкг / мл) инкубировали с 100 нг / мл LPS непосредственно в течение 1 ч при 37 ° C. Клетки RAW 264.7 стимулировали этими смесями в течение 12 ч при 37 ° C. После этого оценивали уровни TNF-α, IL-6 и IL-1β в клеточных супернатантах.
Пептид после обработки
Вкратце, 100 нг / мл LPS добавляли к среде для культивирования клеток и инкубировали с клетками в течение 1 часа при 37 ° C.После этого клетки RAW 264.7 промывали PBS и культивировали со свежей средой, содержащей 10 мкг / мл пептидов, в течение 12 ч при 37 ° C. После этого оценивали уровни TNF-α, IL-6 и IL-1β в клеточных супернатантах.
Конфокальная лазерная сканирующая микроскопия
Клетки RAW264.7 обрабатывали N-концевыми FITC-меченными пептидами в концентрации 10 мкг / мл в течение 24 ч при 37 ° C; во тьме. Затем клетки RAW264.7 трижды промывали PBS, фиксировали параформальдегидом и промывали PBS. Ядра клеток окрашивали DAPI (разведенный 1: 500 в PBS) (Sigma, США) в течение 5 мин и клетки промывали PBS.Вышеуказанные клетки размазывали на предметном стекле, фиксировали и наблюдали с помощью конфокального микроскопа Leica TCA sp5 (Германия).
Проточная цитометрия
Клетки RAW264.7 окрашивали 10 мкг / мл N-концевых FITC-меченных пептидов при 37 ° C в темноте в течение 24 часов. После этого клетки RAW264.7 собирали и пять раз промывали PBS. Средняя интенсивность FITC в клетках была измерена с помощью проточной цитометрии .
Нейтрализация ЛПС
Нейтрализацию ЛПС пептидами оценивали с помощью количественного анализа лизата амебоцитов тахиплеуса по хромогенной конечной точке (CE TAL) с использованием набора QCL-1000 (XIAMEN BIOENDO TECHNOLOGY CO., Китай). LPS ( E. coli , O111: B4, Sigma-Aldrich, США) в конечной концентрации 1,0 Ед / мл инкубировали с различными концентрациями пептидов (конечная концентрация от 0 до 64 мкг / мл) при 37 ° C в течение 15 мин. После этого смеси инкубировали с реагентом для анализа TAL при 37 ° C; в течение 6 мин, и оптическую плотность измеряли при 540 нм.
Вестерн-блоттинг
Клетки RAW264.7, засеянные с плотностью 1,8 × 10 6 клеток / мл инкубировали с ЛПС (100 нг / мл) при 37 ° C в течение 1 часа.После этого клетки тщательно промывали PBS перед обработкой CTP-NH 2 в течение 3 часов при 37 ° C с последующим лизисом клеток. Цитоплазматические и ядерные белковые фракции получали с использованием реагентов для ядерной и цитоплазматической экстракции NR-PER (Thermo Fisher Scientific Inc., New Zwaland). Концентрации белка оценивали с помощью набора CA (KeyGEN Biotech, Нанкин, Китай) в соответствии с инструкциями производителя. После этого общий белок (40 мкг белка / дорожка) разделяли на 10% SDS-PAGE гелях и затем переносили на PVDF-мембраны (Bio-Rad).Затем мембраны блокировали 5% обезжиренным сухим молоком, содержащим 0,05% TBST, а затем проводили иммуноблоттинг со специфическими первичными антителами против IKK-β, p-IKK-β, IкB-α, p-IкB-α, NF-кB. (p65), p-NF-кB (p-p65) и β-актин (Санта-Крус, Калифорния, США). После промывания TBST мембраны инкубировали с конъюгированными с HRP вторичными антителами (HuaAn, Ханчжоу, Китай). Систему визуализации ChemiDoc MP (Bio-Rad, Геркулес, Калифорния, США) использовали для количественной оценки плотности конкретных белков.
Моделирование молекулярной динамики
Первоначальная трехмерная структура пептида была создана с помощью программного обеспечения Chimera.Для оценки аффинности связывания с комплексом TLR4 / MD-2 соответствующая кристаллографическая структура комплекса Toll-подобный рецептор 4 / миелоидный фактор дифференцировки 2 (TLR4 / MD-2) была получена из PDB (код PDB: 2Z64). Недостающие атомы водорода были добавлены Маэстро (36) в условиях pH 7,0. Док-сервер белок-белок RosettaDock (версия 3.5) использовался для прогнозирования и оценки взаимодействий между пептидами и связывающим целевым комплексом TLR4 / MD-2. Чтобы отфильтровать лучшие конформеры докинга, мы выбрали конформации с наименьшей энергией связи и большим количеством водородных связей.
Лучшие позы связывания пептида с TLR4 / MD-2 были подвергнуты моделированию молекулярной динамики (MD) под AMBER14 (37, 38). Белковые системы обрабатывали GAFF и FF14SB и сольватировали в периодических граничных условиях в кубическом ящике с водной моделью TIP3P (39). Атомы Na + и Cl — добавляли для имитации физиологических условий и нейтрализации каждой системы перед получением. Система была сначала минимизирована с помощью алгоритма сопряженного градиента на 5000 шагов, после чего последовал постепенный нагрев в течение 100 пс.Впоследствии объем системы был отрегулирован при постоянном давлении (NPT: количество частиц, давление системы и температура системы оставались постоянными) (40). После этого уравновешенные структуры моделировались при постоянном количестве, объеме и температуре (NVT) в течение 60 нс.
На основе 300 снимков, извлеченных из последних 40 нс уравновешенного МД моделирования, энергия связи была рассчитана на основе метода молекулярной механики Пуассона-Больцмана доступной площади поверхности (MM-PBSA) (41).Метод Particle-mesh Ewald (PME) был использован для расчета дальнодействующих электростатических взаимодействий системы (42).
Поверхностный плазмонный резонанс (SPR)
АнализыSPR проводили с использованием прибора Biacore X100 (GE Healthcare, Питтсбург, Пенсильвания, США). PBS, содержащий 0,05% Tween 20, использовали в качестве рабочего буфера. Текущий буфер непрерывно подавали в реакционную камеру со скоростью 30 мкл / мин. Иммобилизацию CTP-NH 2 на поверхности чипа проводили в соответствии с протоколом амино-связывания.Для получения сенсограмм взаимодействий между пептидами и комплексом TLR4 / MD-2 был проанализирован диапазон концентраций пептидов (0, 1,25, 2,5, 5 и 10 мМ). Рабочий буфер был введен в пустой канал в качестве ссылки. Чтобы регенерировать поверхность чипа в конце каждого эксперимента, вводили 10 мМ Gly-HCl буфер (pH 2,5). Программное обеспечение ProteOn manager (версия 2.0) использовалось для анализа экспериментальных данных. Кривые связывания обрабатывали для совмещения начальной инъекции и базовой линии.Затем сенсограмма за вычетом эталона была подогнана к кривым, описывающим однородную модель 1: 1. Данные с поверхности белков были сгруппированы вместе, чтобы соответствовать константе кинетической скорости ассоциации ( K a) и константе скорости диссоциации ( K d). Константа равновесной диссоциации ( K D) для взаимодействия пептид-TLR4 / MD-2 рассчитывалась следующим образом:
Animal Model
Самцы мышей C57 / BL6 (в возрасте 6-8 недель) были приобретены у Charles River ( Пекин, Китай).Во время экспериментов мышей содержали в среде, свободной от специфических патогенов (SPF), при температуре 22 ± 1 ° C и относительной влажности 55 ± 10%. Анализы были выполнены в соответствии с законами и правилами по лечению живых животных Китайского сельскохозяйственного университета.
Мышей случайным образом распределили на три группы (n = 12 в каждой): контроль, обработка LPS ( E. coli , O111: B4, Sigma-Aldrich, США) и предварительная обработка CTP-NH 2 с последующей обработкой LPS. лечение (CTP-NH 2 + LPS).В течение первых 7 дней CTP-NH 2 (10 мг / кг веса мыши) вводили внутрибрюшинно один раз в день. Между тем, равный объем стерильного физиологического раствора вводили мышам в контрольной группе и группе, получавшей LPS. На 7 день LPS (10 мг / кг веса мыши) вводили внутрибрюшинно мышам в группах LPS и CTP-NH 2 + LPS для создания модели сепсиса на животных. Контрольной группе внутрибрюшинно вводили равный объем физиологического раствора. Через шестнадцать часов после инъекции LPS мышей умерщвляли шейным смещением и собирали образцы кишечника для анализа.
Гистопатология и иммуногистохимия
Ткани печени мыши фиксировали в 4% параформальдегиде, заливали парафином и разрезали на срезы толщиной 5 мкм с помощью микротома RM2235 (Leica, Германия). Срезы окрашивали гематоксилин-эозином (H&E), и для получения изображений использовали микроскоп DM3000. LPS-индуцированное повреждение печени оценивали по следующим четырем категориям: альвеолярный застой, кровоизлияние, инфильтрация нейтрофилов в воздушное пространство или стенку сосуда и толщину альвеолярной стенки / образование гиалиновой мембраны.Оценка повреждения печени оценивалась по шкале от 0 до 4 баллов: 0 — нет травмы; 1, до 25% травм в полевых условиях; 2, до 50% травм в полевых условиях; 3, до 75% травм в полевых условиях; 4, диффузная травма (43).
Для иммуногистохимического анализа срезы блокировали PBS, содержащим 1% BSA, в течение 1 часа при комнатной температуре. После этого срезы инкубировали с антителом против CD177 + (1: 100; Санта, США). Образцы промывали PBS с последующей инкубацией с кроличьими антителами к козьим IgG, конъюгированными с пероксидазой хрена (HRP) (1: 100; JIR, США), при 4 ° C в течение 1 часа.Затем слайды окрашивали 3,3’-диаминобензидином (DAB; DAKO, США), а затем контрастировали гематоксилином Харриса. Наконец, образцы были обезвожены в градиенте спирта (70-100%) и очищены ксилолом. Все предметные стекла были закреплены в нейтральном бальзаме.
ELISA
Уровни фактора некроза опухоли (TNF) -α, интерлейкина (IL) -6 и IL-1β в супернатантах клеточных культур и уровни TNF-α, IL-6 и IL-1β в сыворотки мышей определяли с помощью коммерческих наборов для ELISA (eBioscience, Сан-Диего, США) в соответствии с инструкциями производителя.Уровни сывороточной аланинаминтрансферазы (ALT) и аспартатаминотрансферазы (AST) определяли с использованием коммерческих наборов реагентов (Nanjing Jiancheng Bioengineering Institute, Нанкин, Китай). Активность миелопероксидазы (МПО) в печени мышей определяли с помощью набора для ELISA (Boster, Wuhan, China) в соответствии с инструкциями производителя.
Статистика
Все данные выражены как средние значения ± стандартное отклонение по крайней мере трех независимых экспериментов.Статистические сравнения проводили с помощью t-теста Стьюдента с использованием программного обеспечения GraphPad Prism v6 (Ла-Хойя, Калифорния). Значимость была заявлена при значениях p ≤ 0,05; NS: p> 0,05, *: p ≤ 0,05, **: p ≤ 0,01, ***: p ≤ 0,001 и ****: p ≤ 0,0001.
Результаты
Дизайн и характеристика пептида
Как показано в Таблице 1, гибридный пептид CTP был разработан путем комбинирования основной функциональной области CATh3 с TP5. МС использовали для проверки молекулярной массы пептидов.Измеренные молекулярные массы пептидов соответствовали теоретическим значениям, которые предполагали, что пептиды были синтезированы успешно.
Таблица 1 Основные физико-химические параметры родительских и гибридных пептидов.
Цитотоксичность для клеток макрофагов RAW264.7
Цитотоксическая активность CTP и его родительских пептидов в отношении макрофагов RAW264.7 определялась с помощью анализов CCK-8 (рис. 1). Макрофаги RAW264.7 обрабатывали пептидами в серии концентраций от 0 до 80 мкг / мл.CTP проявлял более низкую цитотоксичность, чем исходный пептид (CATh3), но более высокую цитотоксичность, чем TP5. После инкубации с 10 мкг / мл пептидов в течение 24 часов (Рисунок 1A) и 72 часов (Рисунок 1B) жизнеспособность обработанных пептидом клеток RAW264.7 была более 80%. Эти данные показывают, что при 10 мкг / мл все пептиды были минимально цитотоксичными для клеток RAW264.7 и, таким образом, подходили для дальнейших противовоспалительных экспериментов.
Рисунок 1 Скорость пролиферации клеток RAW264.7 в отсутствие или в присутствии CATh3-TP5 (CTP) и его родительских пептидов.Клетки RAW264.7 предварительно засевали в DMEM в течение ночи. Макрофаги RAW264.7 обрабатывали пептидами в серии концентраций от 0 до 80 мкг / мл при 37 ° C и 5% CO 2 в течение 24 часов (A) или 72 часов (B) . Клетки инкубировали с раствором CCK-8 в течение 4 ч. Наконец, значение OD было измерено при 450 нм. Данные представлены как среднее значение ± стандартное отклонение для восьми биологических повторов. NS: p> 0,05, * p ≤ 0,05, ** p ≤ 0,01 и *** p ≤ 0,001.
Противовоспалительный эффект CTP в RAW264, стимулированном LPS.7 Клетки
Для оценки противовоспалительного действия CTP и его родительских пептидов, CATh3 и TP5, в качестве модели использовали клетки RAW264.7. Результаты показали, что LPS вызывал значительное повышение провоспалительных цитокинов TNF-α (рис. 2A), IL-6 (рис. 2B) и IL-1β (рис. 2C) по сравнению с необработанными клетками. Как показано на фиг. 2A – C, все пептиды ослабляли уровни секреции TNF-α, IL-1β и IL-6. Кроме того, по сравнению с исходными пептидами CTP проявлял повышенную ингибирующую активность против LPS-индуцированного воспаления.
Фиг. 2 Противовоспалительный эффект CATh3-TP5 (CTP) в LPS-стимулированных клетках RAW264.7. Клетки RAW264.7 обрабатывали пептидами 10 мкг / мл или без них в течение 30 мин перед добавлением 100 нг / мл ЛПС и последующей инкубацией в течение 12 ч при 37 ° C. После обработки концентрации TNF-α (A) , IL-6 (B) и IL-1β (C) в супернатантах клеток оценивали с использованием наборов для ELISA. Данные представлены как среднее значение ± стандартное отклонение для восьми биологических повторов.* p ≤ 0,05 и *** p ≤ 0,001.
CTP оказывает свой противовоспалительный эффект посредством активности по нейтрализации LPS
Для идентификации противовоспалительных механизмов CTP был проведен эксперимент с добавлением времени для CTP против LPS-индуцированного воспаления. Клетки LPS или RAW 264.7 инкубировали с CTP в концентрации 10 мкг / мл в течение различных периодов времени, и противовоспалительные эффекты измеряли с помощью ELISA. После инкубации с LPS, CTP проявлял сильное ингибирование высвобождения провоспалительных цитокинов, включая TNF-α (Рисунок 3A) и IL-6 (Рисунок 3B), предполагая, что CTP может проявлять свою противовоспалительную активность посредством взаимодействия с LPS.Чтобы проверить, как CTP работает с LPS, был проведен дополнительный тест in vitro. Результаты показали, что CTP ингибирует активацию LPS дозозависимым образом (рис. 3C). Значение скорости связывания 50% CTP составляло приблизительно 45,32 ± 5,19 мкг / мл. Напротив, CTP практически не снижал повышение провоспалительных цитокинов TNF-α (фиг. 3A) и IL-6 (фиг. 3B) при использовании для предварительной обработки клеток или добавлении к клеткам после индукции LPS. Эти результаты свидетельствуют о том, что CTP проявляет противовоспалительную активность только при прямом взаимодействии с LPS, но не ингибирует прикрепление LPS и не влияет на внутриклеточную противовоспалительную активность.
Рисунок 3 Комплексная противовоспалительная активность и клеточная локализация CATh3-TP5 (CTP). Время добавления экспериментов были проведены для определения противовоспалительной активности CTP. Клетки RAW264.7 обрабатывали CTP во время экспериментов по добавлению. Клетки или липополисахарид (LPS) обрабатывали CTP в конечной концентрации 10 мкг / мл в трех различных режимах обработки. Концентрации TNF-α (A) и IL-6 (B) указывают на противовоспалительную активность CTP в каждом режиме лечения. (C) In vitro Нейтрализация LPS с помощью CTP. Активность CTP по нейтрализации LPS оценивалась in vitro с помощью анализа хромогенного лизата тахиплеуса амебоцитов (TAL). (D) Клеточная локализация CTP в клетках RAW264.7. Пептид был помечен FITC, и клеточная локализация CTP была оценена с помощью конфокальной микроскопии после инкубации в течение 24 часов с клетками RAW264.7. Масштабные линейки: 10 мкм. Данные представлены как среднее значение ± стандартное отклонение для трех биологических повторов.NS: p> 0,05 и *** p ≤ 0,01.
Учитывая значительную разницу между внеклеточной и внутриклеточной противовоспалительной активностью CTP, мы предположили, что CTP может иметь низкое клеточное поглощение в клетках RAW264.7 и / или неблагоприятную внутриклеточную локализацию. Клетки RAW264.7 инкубировали с меченным FITC CTP в концентрации 10 мкг / мл, а затем исследовали с помощью конфокальной микроскопии. Как показано на рисунке 3D, меченный FITC CTP редко проникал в клетки RAW264.7, что объясняет его низкую внутриклеточную противовоспалительную активность.
Дизайн модифицированного амидированием пептида на основе молекулярной матрицы CTP
CTP был разработан и модифицирован для получения С-концевого амидированного производного пептида, CTP-NH 2 . Структура и молекулярная масса CTP-NH 2 были подтверждены с помощью МС. Время удерживания ВЭЖХ использовали для надежного отражения гидрофобности ЦТФ и ЦТФ-NH 2 в водном растворе (44). Время удерживания для CTP и CTP-NH 2 составляло 10,94 мин и 11,96 мин, соответственно, что указывает на то, что CTP-NH 2 более гидрофобен, чем CTP (таблица 2).
Таблица 2 Ключевые параметры CATh3-TP5 (CTP) и его C-концевого амидированного производного пептида CTP-NH 2 .
Противовоспалительная активность и клеточное поглощение производного пептида CTP (CTP-NH
2 )Цитотоксичность производного CTP пептида CTP-NH 2 в клетках RAW264.7 оценивали с помощью анализов CCK-8 ( Рисунки 4A, B). Как показали результаты, CTP-NH 2 проявлял меньшую цитотоксичность, чем CTP, что указывает на то, что CTP-NH 2 подходит для последующих экспериментов.
Рисунок 4 Цитотоксичность, противовоспалительная активность и внутриклеточное распределение CTP-NH 2 . Цитотоксичность CATh3-TP5 (CTP) и CTP-NH 2 оценивали в клетках RAW264.7 с использованием анализов CCK-8. Макрофаги RAW264.7 обрабатывали пептидами в серии концентраций от 0 до 80 мкг / мл при 37 ° C и 5% CO 2 в течение 24 часов (A) или 72 часов (B) . NS: p> 0,05, * p ≤ 0,05, ** p ≤ 0,01 и *** p ≤ 0,001.
Режимы действия CTP-NH 2 определяли по времени экспериментов по добавлению, как описано ранее. После инкубации с LPS CTP-NH 2 проявлял большую эффективность, чем CTP, в ингибировании секреции TNF-α (фиг. 5A) и IL-6 (фиг. 5B). Кроме того, активность CTP-NH 2 по нейтрализации LPS была выше, чем у CTP (рис. 5C). Эти результаты показывают, что CTP-NH 2 обладает большей ингибирующей активностью против LPS-индуцированного воспаления за счет нейтрализации LPS.Интересно, что CTP-NH 2 также снижал концентрацию TNF-α (фиг. 5A) и IL-6 (фиг. 5B) при использовании для предварительной обработки клеток или добавлении к клеткам после индукции LPS, тогда как CTP почти не оказывал таких эффектов.
Фиг. 5 Противовоспалительная активность и внутриклеточное распределение CTP-NH 2 . Анализ противовоспалительной активности CTP-NH 2 в эксперименте с временным сложением. Концентрации TNF-α (A) и IL-6 (B) показывают противовоспалительный эффект CTP-NH 2 в каждом режиме лечения. (C) In vitro Нейтрализация LPS с помощью CTP-NH 2 . Липополисахаридная (LPS) активность CTP-NH 2 по нейтрализации была оценена как in vitro с использованием хромогенного анализа TAL. (D) Конфокальное микроскопическое исследование клеточной локализации CTP и CTP-NH 2 . Меченый FITC CTP или CTP-NH 2 использовали для обработки клеток RAW264.7 в течение 24 часов, а локализацию клеток оценивали с помощью конфокальной микроскопии. Одно и то же изображение клеточной локализации CTP используется как на Рисунке 5D, так и на Рисунке 3D.Масштабные линейки: 10 мкм. (E) Измерение с помощью проточной цитометрии клеточного поглощения CTP и CTP-NH 2 . Пептиды метили FITC и инкубировали с макрофагами RAW264.7 в течение 24 часов, и среднюю интенсивность FITC в каждой клетке определяли с помощью проточной цитометрии. Данные представлены как среднее значение ± стандартное отклонение по крайней мере из трех биологических повторов. NS: p> 0,05, * p ≤ 0,05, ** p ≤ 0,01 и *** p ≤ 0,001.
Чтобы определить, способствует ли интернализация производного CTP пептида CTP-NH 2 аминированием С-конца, CTP и CTP-NH 2 метили FITC и инкубировали с RAW264.7 ячеек на 24 ч. Впоследствии конфокальная микроскопия и проточная цитометрия использовались для измерения клеточного поглощения и локализации пептидов. Результаты показали, что CTP-NH 2 способствует значительному клеточному поглощению и диспергированному распределению по сравнению с CTP (Фигуры 5D, E).
CTP-NH
2 Проявляет внутриклеточную противовоспалительную активность путем связывания TLR4 / MD-2 и ингибирования сигнального пути NF-κBДля исследования внутриклеточного противовоспалительного механизма CTP-NH 2 , связывание CTP -NH 2 к TLR4 / MD-2 исследовали с помощью SPR-анализа.Ряд концентраций от 0 до 10 мкМ пропускали через иммобилизованный TLR4 / MD-2. Результаты показали, что пептиды, связывающиеся со связанным с чипом белком, демонстрируют дозозависимое увеличение (Фигуры 6A, B). Рассчитанные значения K a и K d для связывания CTP-NH 2 и TLR4 / MD-2 составили 1,65 × 10 7 с –1 и 1,56 × 10 M –1 с — 1 , а значение K D составило 9,47 × 10 -1 мкМ (рис. 6В). Кроме того, рассчитанные значения K a и K d для связывания CTP и TLR4 / MD-2 равнялись 1.34 × 10 7 с –1 и 1,87 × 10 M –1 с –1 , а значение K D составляло 1,40 мкМ (рис. 6А). Эти результаты подтвердили, что аффинность связывания CTP-NH 2 с рецептором TLR4 / MD-2 была выше, чем аффинность связывания CTP с TLR4 / MD-2.
Рисунок 6 Внутриклеточный противовоспалительный механизм пептидов. Пептид иммобилизовали на сенсорном чипе, и связывание CTP (A) и CTP-NH 2 (B) с комплексом TLR4 / MD-2 анализировали с помощью поверхностного плазмонного резонанса.Смоделированная кристаллическая структура CTP (C) или CTP-NH 2 (D) , связанных в гидрофобном «кармане» MD2 в комплексе TLR4 / MD2. Справа показаны увеличенные изображения занятых CTP или CTP-NH 2 сайтов в комплексе TLR4 / MD2. Кристаллическая структура TLR4 отображается желтым цветом. Структура MD-2 окрашена в серый цвет, а CTP-NH 2 — в зеленый. Данные представлены как среднее значение ± стандартное отклонение по крайней мере из трех биологических повторов.
После этого для дальнейшего прогнозирования эффекта связывания CTP-NH 2 с комплексом TLR4 / MD-2 было выполнено моделирование MD. Всего 300 снимков для комплекса пептид-TLR4 / MD-2 наблюдали за последние стабильные 40 нс моделирования МД. Свободную энергию связывания использовали для отражения аффинности связывания пептида. Как показано в таблице 3, энергия связи CTP-NH 2 составляла -1 181,25 кДж / моль, что было выше, чем энергия связи CTP. Кроме того, интерфейс TLR4 / MD-2, который связан с пептидом (Фигуры 6C-F), сравнивали с интерфейсом LPS (45).Гидрофобный карман TLR4 / MD-2 для связывания CTP-NH 2 имеет те же сайты связывания и аналогичные остатки, что и те, которые связывают LPS (фигура 6C и таблица 4). Взаимодействие между CTP-NH 2 и TLR4 / MD-2 в основном опосредовано водородными связями и солевыми мостиками (таблица 4). Кроме того, пара взаимодействия TLR4 / MD-2-CTP-NH 2 имела больше водородных связей и солевых мостиков и большую площадь поверхности взаимодействия, чем пары TLR4 / MD-2-CTP. Это согласуется с результатами SPR и предполагает, что CTP-NH 2 проявляет свою внутриклеточную противовоспалительную активность, блокируя связывание LPS с комплексом TLR4 / MD-2.
Таблица 3 Ключевые параметры взаимодействия между пептидом и MD-2.
Таблица 4 Расстояние и солевые мостики связывающих остатков между пептидом и MD-2.
Затем был исследован сигнальный путь NF-кB для определения внутриклеточного противовоспалительного механизма CTP-NH 2 . ЛПС значительно увеличивал фосфорилирование IKK-β, IкB-α и NF-кB, в то время как клетки, обработанные CTP-NH 2 , демонстрировали пониженные уровни IKK-β, IкB-α и NF-кB (Рисунок 7 ).Эти результаты предполагают, что внутриклеточное противовоспалительное действие CTP-NH 2 на сигнальный путь NF-κB играет решающую роль в процессе, посредством которого CTP-NH 2 модулирует LPS-индуцированное воспаление.
Рисунок 7 Влияние CTP на сигнальные пути NF-кB. Уровни фосфорилированного и общего белка IKK-β, IκB-α, NF-кB и β-актина в сыворотке измеряли с помощью вестерн-блоттинга. * p ≤ 0,05 и ** p ≤ 0,01.
Защитные эффекты CTP-Nh3 против LPS-индуцированного сепсиса
Для характеристики ингибирующего действия CTP-NH 2 против LPS-индуцированного сепсиса, концентрации воспалительных маркеров TNF-α, IL-6 и IL -1β в сыворотке мыши определяли как с помощью ELISA .По сравнению с контрольной группой, провокация LPS приводила к значительному увеличению уровней TNF-α (фигура 8A), IL-6 (фигура 8B) и IL-1β (фигура 8C) в сыворотке мышей, тогда как CTP-NH В группе, получавшей 2 , наблюдались значительно сниженные уровни TNF-α, IL-6 и IL-1β по сравнению с таковыми в группе, получавшей LPS.
Рисунок 8 Защитные эффекты CTP-Nh3 против LPS-индуцированного сепсиса у мышей. (10 мг / кг) вводили мышам один раз в день в течение 6 дней, тогда как контрольной группе и группе, обработанной LPS, вводили равный объем стерильного физиологического раствора.На 6 день мышам в группах, получавших LPS и пептид, вводили LPS (10 мг / кг) через 1 час после обработки пептидом или физиологическим раствором. Контрольной группе вводили равный объем физиологического раствора. ELISA выполняли для обнаружения TNF-α (A) , IL-6 (B) и IL-1β (C) в сыворотке. Экспрессия аланинаминтрансферазы (ALT) (D) и аспартаттрансаминазы (AST) (E) в сыворотке крови. (F) Влияние CTP-Nh3 на показатели повреждения печени. (G) Репрезентативные окрашенные H и E срезы из групп (а) контроля, (b) LPS и (c) CTP-Nh3 + LPS. Пруток, 50 мкм. (H) Типичные изображения клеток CD177 +. Пруток, 50 мкм. Фиксированные формалином, залитые парафином поперечные срезы 5 мм окрашивали первичным Ab против CD177 +. (а) контроль, (б) LPS и (в) группы CTP-Nh3 + LPS. Ферментативная активность МПО была измерена (I) . Данные представлены как среднее значение ± стандартное отклонение по крайней мере из трех биологических повторов. *** p ≤ 0.001.
LPS явно вызывал повышение ALT и AST, маркеров функции печени, тогда как CTP-NH 2 значительно ослаблял эти эффекты (фигуры 8D, E). Кроме того, по сравнению с контрольной группой, ЛПС вызывал значительное повреждение тканей с нарушением архитектуры печени, обширным кровотечением, некрозом гепатоцитов и инфильтрацией воспалительных клеток (рис. 8G). Напротив, тяжесть повреждения печени была уменьшена предварительной обработкой CTP-NH 2 (фигура 8G). Эти защитные эффекты были подтверждены анализом повреждений печени (фиг. 8F).
Кроме того, результаты иммуногистохимии показали, что LPS запускает повышенную инфильтрацию нейтрофилов CD177 + в область поражения печени по сравнению с контролем (фигура 8H). Однако инфильтрация нейтрофилов была значительно ниже в группе, получавшей CTP-NH 2 , чем в группе, получавшей LPS. В качестве индекса нейтрофильной инфильтрации и воспаления (46) активность МПО в печени мышей оценивали с помощью ELISA. В соответствии с результатами иммуногистохимии активность МПО была заметно увеличена у мышей, обработанных LPS, но предварительная обработка CTP-NH 2 значительно снизила этот эффект (фиг. 8I).
Обсуждение
В последние годы было открыто или разработано множество противовоспалительных пептидов, и некоторые из них обладают потенциальной активностью по нейтрализации ЛПС (7, 47, 48). Однако их развитие было ослаблено рядом проблем, включая потенциальную цитотоксичность (22), слабую физиологическую стабильность и низкую противовоспалительную активность (49). Для получения нового противовоспалительного пептида с повышенной активностью, но с минимальной цитотоксичностью была предложена гибридизация (50, 51).Наша группа завершила несколько исследований гибридных противовоспалительных пептидов, которые могут улучшить противовоспалительную активность и снизить нежелательные цитотоксические эффекты нативных пептидов (52, 53). Противовоспалительные эксперименты показали, что новые разработанные пептиды могут ингибировать LPS-индуцированное воспаление путем нейтрализации LPS, связывания с комплексом TLR4 / MD-2 или ингибирования сигнального пути NF-кB (52, 53).
В этом исследовании мы разработали гибридный пептид, объединив активный центр CATh3 (1–13) (14) с TP5.Противовоспалительная активность гибридного пептида и его исходных пептидов была подтверждена с помощью ELISA на клетках RAW264.7. CTP, новый разработанный пептид, заметно снизил уровни TNF-α, IL-6 и IL-1β по сравнению с его родительскими пептидами, CATh3 и TP5. Цитотоксичность CTP была дополнительно протестирована, и результаты показали, что CTP имеет более низкую цитотоксичность, чем его родительский пептид (CATh3). Кроме того, CTP минимально токсичен при концентрации 10 мкг / мл. К сожалению, CTP почти не оказывал ингибирования секреции TNF-α и IL-6 при предварительной инкубации с клетками перед индукцией LPS или добавлении к клеткам после индукции LPS.Кроме того, CTP проявлял ингибирование только при добавлении к клеткам, инкубируемым с LPS. Анализы с конфокальной микроскопией и проточной цитометрией показали, что CTP демонстрирует чрезвычайно низкое клеточное поглощение, поскольку в инкубированных клетках не было обнаружено видимых FITC-меченых CTP.
Чтобы преодолеть трудности доступа пептидов и проникновения в клетку, были использованы различные методы. Например, введение остатков гистидина (27, 28) или добавление D-аминокислот (29, 30) может усилить трансмембранную доставку пептида.Кроме того, гидрофобность пептидов требуется для повышенного поглощения клетками (31, 32), а C-концевое амидирование, как сообщается, увеличивает гидрофобность пептидов (33). Эти исследования показали, что C-концевое амидирование может использоваться для усиления клеточного захвата и противовоспалительной активности (54, 55).
В нашем исследовании CTP был разработан и модифицирован для получения C-концевого амидированного производного пептида. Время удерживания ВЭЖХ показало, что производное пептида (CTP-NH 2 ) проявляет более сильную гидрофобность, чем CTP.Кроме того, производное пептида CTP-NH 2 показало улучшенную противовоспалительную активность и пониженную цитотоксичность. Анализ секреции TNF-α и IL-6 показал, что CTP-NH 2 проявляет большую ингибирующую активность против LPS-индуцированного воспаления при инкубации с LPS в среде для культивирования клеток по сравнению с CTP, что может быть связано с более сильной LPS-нейтрализующей активностью CTP. -NH 2 . Кроме того, стоит отметить, что CTP-NH 2 также снижал концентрацию TNF-α и IL-6 при использовании для предварительной обработки клеток или добавлении к клеткам после индукции LPS, тогда как CTP практически не оказывал таких эффектов.Результаты проточной цитометрии и конфокальной микроскопии показали, что CTP-NH 2 демонстрирует значительное клеточное поглощение и диспергированное распределение, что может объяснить его противовоспалительную активность. Следовательно, эти результаты показывают, что C-концевое амидирование молекул CTP может повышать гидрофобность и, таким образом, преодолевать барьеры в клеточном захвате и улучшать противовоспалительную активность.
Чтобы идентифицировать механизмы наблюдаемых противовоспалительных эффектов, когда клетки предварительно обрабатывали пептидом или пептид добавляли к клеткам после индукции LPS, был проведен всесторонний и подробный анализ.Toll-подобный рецептор (TLR) наделен способностью распознавать консервативные молекулярные паттерны микробных патогенов и вызывать иммунные ответы в защите хозяина (56, 57). TLR4 в первую очередь активируется узнаванием LPS через дополнительный белок MD-2 (58). Следовательно, блокирование TLR4 / MD-2 является потенциальным механизмом ослабления LPS-индуцированного воспалительного ответа (59–61). Для исследования способности CTP-NH 2 связываться с комплексом TLR4 / MD-2 были выполнены анализы связывания SPR. Результаты SPR подтвердили, что CTP-NH 2 может эффективно связываться с TLR4 / MD-2.Соответственно, моделирование MD показало, что CTP-NH 2 может связываться с гидрофобным карманом MD-2, который частично перекрывается с сайтом связывания LPS на MD-2 (45). Таким образом, результаты показывают, что CTP-NH 2 придает свою противовоспалительную активность посредством блокирования связывания LPS с комплексом TLR4 / MD-2. Кроме того, LPS является сильным активатором сигнального пути NF-κB, хотя он взаимодействует с TLR4 (62). Таким образом, NF-κB играет решающую роль в защите хозяина посредством регуляции экспрессии воспалительных генов (63).В настоящем исследовании экспрессия основных белков, участвующих в пути NF-κB, была обнаружена с помощью вестерн-блоттинга для выяснения противовоспалительного механизма CTP-NH 2. Результаты показали, что CTP-NH 2 эффективно ингибирует активация пути NF-κB за счет снижения фосфорилирования IKK-β, IкB-α и NF-кB.
Противовоспалительная активность in vivo CTP-NH 2 также оценивалась на мышиной модели сепсиса, индуцированной LPS.LPS, основной эндотоксин, считается основной причиной сепсиса (3). Кроме того, сообщалось, что 20 мг / кг ЛПС вызывают сепсис in vivo , который может вызывать чрезмерное воспаление и органную недостаточность, например, в ткани печени (64). В соответствии с предыдущими исследованиями, настоящее исследование показало, что уровни TNF-α, IL-6 и IL-1β были заметно увеличены у мышей, получавших LPS, в то время как предварительная обработка CTP-NH 2 эффективно снижала этот эффект. Повреждение печени считается одной из самых серьезных проблем со здоровьем в мире, может быть вызвано различной этиологией и связано с высокой смертностью (65).В этом исследовании LPS индуцировал повреждение печени с очевидными изменениями биохимических и гистопатологических параметров. В качестве биохимических маркеров повреждения печени AST и ALT используются для отражения повреждения печени во время клинических испытаний. Настоящее исследование показало, что ЛПС заметно увеличивает АСТ и АЛТ. Однако CTP-NH 2 эффективно снижал уровни AST и ALT. Кроме того, гистологический анализ показал, что CTP-NH 2 устраняет кровоизлияние и клеточный некроз в печени. Инфильтрация активированных нейтрофилов, одна из наиболее характерных гистологических особенностей, наблюдаемых при воспалении печени (66), была значительно увеличена у мышей, получавших LPS.Однако предварительная обработка CTP-NH 2 предотвратила инфильтрацию активированных нейтрофилов в печени. В соответствии с этим, активность МПО в печени, индекс нейтрофильной инфильтрации и воспаления, была значительно увеличена у мышей, получавших LPS, но предварительная обработка CTP-NH 2 значительно снизила этот эффект. В совокупности эти результаты показывают, что CTP-NH 2 может эффективно предотвращать LPS-индуцированный сепсис у мышей.
Заключение
Успешный дизайн и модификация CTP может предоставить возможность модифицировать ранее открытые пептиды для улучшения их противовоспалительных свойств или разработать новые активные пептидные агенты с превосходным клеточным захватом и противовоспалительной активностью (рис. 9).Кроме того, наше исследование показало, что противовоспалительные эффекты CTP-NH 2 связаны с нейтрализацией LPS, активностью связывания с комплексом TLR4 / MD-2 и ингибированием сигнального пути NF-кB.
Фигура 9 Схематическое изображение дизайна и разработки нового гибридного пептида, CTP-NH 2 , для лечения LPS-индуцированного воспаления.
Заявление о доступности данных
Исходные материалы, представленные в исследовании, включены в статью / дополнительные материалы.Дальнейшие запросы можно направить соответствующему автору.
Заявление об этике
Исследование на животных было рассмотрено и одобрено Комитетом по уходу и использованию животных Китайского сельскохозяйственного университета.
Вклад авторов
LZ, XW, RZ, MK и DS разработали проект и разработали эксперименты. LZ, XW, BA и HG проводили эксперименты. LZ и MK написали рукопись и проанализировали данные. Все авторы прочитали рукопись и прокомментировали ее. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана Национальной программой ключевых исследований и разработок Китая (проект № 2018YFD0500600), Национальным фондом естественных наук Китая (NSFC, 31572442) и Национальным фондом естественных наук Китая (NSFC, 31272476).
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Сокращения
CATh3, кателицидин 2; CATh3-TP5, CTP; CCK-8, набор для подсчета клеток-8; CE TAL, Chromogenic End-point Tachypleus Amebocyte Lysate; DAB, 3,3’диаминобензидин; DMEM, среда Игла, модифицированная Дульбекко; FBS, фетальная бычья сыворотка; HRP, пероксидаза хрена; H&E, гематоксилин-эозин; ИЛ-6, интерлейкин-6; ЛПС, липополисахарид; MD, молекулярная динамика; MM-PBSA, доступная площадь поверхности Пуассона-Больцмана; МПО, миелопероксидаза; NF-кB, ядерный фактор-каппа B; NPT, число, давление и температура; NVT, количество, объем и температура; SPF, свободный от специфических патогенов; TLR4 / MD-2, Toll-подобный рецептор 4 / фактор дифференцировки миелоида 2; TNF-α, фактор некроза опухоли-альфа; ТП5, тимопентин.
Ссылки
2. Матрикон Дж. Иммунопатогенез воспалительного заболевания кишечника. M S-Med Sci (2010) 26 (4): 405–10. doi: 10.1051 / medsci / 2010264405
CrossRef Полный текст | Google Scholar
3. Ge XT, Feng ZG, Xu TT, Wu BB, Chen HJ, Xu FL, et al. Новое производное имидазопиридина, X22, ослабляет вызванное сепсисом повреждение легких и печени путем ингибирования воспалительной реакции in vitro и in vivo. Drug Des Dev Ther (2016) 10: 1947–59.doi: 10.2147 / Dddt.S101449
CrossRef Полный текст | Google Scholar
4. Ning CQ, Gao XG, Wang CY, Huo XK, Liu ZH, Sun HJ и др. Защитные эффекты гинсенозида Rg1 против индуцированного липополисахаридом / D-галактозамином острого повреждения печени у мышей посредством ингибирования пути передачи сигнала толл-подобного рецептора 4. Int Immunopharmacol (2018) 61: 266–76. doi: 10.1016 / j.intimp.2018.06.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Пуарель Л., Джейол А., Нордманн П.Полимиксины: антибактериальная активность, тестирование чувствительности и механизмы устойчивости, кодируемые плазмидами или хромосомами. Clin Microbiol Rev (2017) 30 (2): 557–96. doi: 10.1128 / Cmr.00064-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Хайнбокель Л., Вайндл Г., Мартинес-де-Техада Дж., Корреа В., Санчес-Гомес С., Барсена-Варела С. и др. Ингибирование воспаления, индуцированного липополисахаридами и липопротеинами, антитоксиновым пептидом пептидом 19-2.5. Front Immunol (2018) 9: 1704.doi: 10.3389 / fimmu.2018.01704
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Wu BC, Lee AHY, Hancock REW. Механизмы противовоспалительной активности регулятора врожденной защиты пептида-1002 на модели стерильных мышей с воспалением. Дж. Иммунол (2017) 199 (10): 3592–603. doi: 10.4049 / jimmunol.1700985
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Zong X, Hu WY, Song DG, Li Z, Du HH, Lu ZQ и др. Пептид LFP-20, полученный из свиного лактоферрина, защищает кишечный барьер, поддерживая комплекс плотных контактов и модулируя воспалительный ответ. Biochem Pharmacol (2016) 104: 74–82. doi: 10.1016 / j.bcp.2016.01.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Акияма Т., Нийонсаба Ф., Киацураянон С., Нгуен Т.Т., Ушио Х., Фудзимура Т. и др. Пептид защиты хозяина кателицидин LL-37 человека активирует белки, связанные с плотными соединениями, и увеличивает барьерную функцию эпидермальных кератиноцитов человека. Дж. Врожденный иммунитет (2014) 6 (6): 739–53. doi: 10.1159 / 000362789
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Ю Дж., Мукхерджи Н., Ви К., Боудиш ДМЕ, Пистолик Дж., Ли YX и др. Пептид защиты хозяина LL-37, в синергии с воспалительным медиатором IL-1 бета, усиливает иммунные ответы несколькими путями. J Immunol (2007) 179 (11): 7684–91. doi: 10.4049 / jimmunol.179.11.7684
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Barlow PG, Li YX, Wilkinson TS, Bowdish DME, Lau YE, Cosseau C, et al. Человеческий катионный защитный пептид хозяина LL-37 опосредует противоположные эффекты на пути апоптоза в различных первичных клетках врожденной иммунной системы. J Leukocyte Biol (2006) 80 (3): 509–20. doi: 10.1189 / jlb.1005560
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Йонссон Д., Нильссон Б.О. Противомикробный пептид LL-37 обладает противовоспалительным и проапоптотическим действием в клетках периодонтальной связки человека. J Периодонтальный анализ (2012) 47 (3): 330–5. doi: 10.1111 / j.1600-0765.2011.01436.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. van Dijk A, van Eldik M, Veldhuizen EJA, Tjeerdsma-van Bokhoven HLM, de Zoete MR, Bikker FJ, et al.Иммуномодулирующая и противовоспалительная активность пептидов, полученных из куриного кателицидина-2. PloS One (2016) 11 (2). doi: 10.1371 / journal.pone.0147919
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Гольдштейн Г., Шейд М.П., Бойз Э.А., Шлезингер Д.Х., Ванвауве Дж. Синтетический пентапептид с биологической активностью, характерной для тимического гормона тимопоэтина. Science (1979) 204 (4399): 1309–10. DOI: 10.1126 / science.451537
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Сингх В.К., Бисвас С., Матур КБ, Хак В., Гарг С.К., Агарвал С.С. Тимопентин и спленопентин как иммуномодуляторы. Современное состояние. Immunol Res (1998) 17 (3): 345–68. doi: 10.1007 / Bf02786456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Новоселова Е.Г., Лунин С.М., Хренов М.О., Новоселова Т.В., Фесенко Е.Е. Участие фактора транскрипции NF-kappaB в противовоспалительной активности пептидов тимуса. Докл. Биол. Наук (2009) 428: 484–6.
PubMed Аннотация | Google Scholar
18.Haddad JJ. Тимулин и цинк (Zn2 +) — опосредованное ингибирование индуцированного эндотоксином производства провоспалительных цитокинов и ядерной транслокации NF-kappaB и активации в альвеолярном эпителии: раскрытие молекулярного иммуномодулирующего, противовоспалительного эффекта тимулина / Zn2 + in vitro. Мол. Иммунол (2009) 47 (2-3): 205–14. doi: 10.1016 / j.molimm.2009.09.034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Энрикес-Коэльо Т., Оливейра С.М., Моура Р.С., Ронкон-Альбукерке Р., Невес А.Л., Сантос М. и др.Тимулин подавляет индуцированную монокроталином легочную гипертензию, модулируя экспрессию интерлейкина-6 и подавляя путь p38. Эндокринология (2008) 149 (9): 4367–73. DOI: 10.1210 / en.2008-0018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Мендлинг В., Колдовский Ю. Исследования клеточно-опосредованными иммунологическими тестами и терапевтические испытания с тимопентином при вагинальных микозах. Infect Dis Obstet Gynecol (1996) 4 (4): 225–31. doi: 10.1155 / S1064744996000439
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.London WB, Castel V, Monclair T, Ambros PF, Pearson ADJ, Cohn SL и др. Клинические и биологические особенности, позволяющие прогнозировать выживаемость после рецидива нейробластомы: отчет Международного проекта группы риска нейробластомы. J Clin Oncol (2011) 29 (24): 3286–92. doi: 10.1200 / Jco.2010.34.3392
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Андерс Э., Даль С., Свенссон Д., Нильссон Б.О. Цитотоксичность и проницаемость остеобластов человека, индуцированные LL-37, происходят независимо от клеточного поглощения LL-37 посредством клатрин-опосредованного эндоцитоза. Biochem Bioph Res Co (2018) 501 (1): 280–5. doi: 10.1016 / j.bbrc.2018.04.235
CrossRef Полный текст | Google Scholar
23. Gonser S, Crompton NEA, Folkers G, Weber E. Повышенная радиационная токсичность за счет увеличения апоптотического клиренса клеток HL-60 в присутствии пентапептида тимопентина, который избирательно связывается с апоптотическими клетками. Mutat Res-Gen Tox En (2004) 558 (1-2): 19–26. doi: 10.1016 / j.mrgentox.2003.10.010
CrossRef Полный текст | Google Scholar
24.Ху X, Чжао М., Ван Й.Дж., Ван Ю.Н., Чжао С.Р., Ву Дж.Х. и др. Тетрагидро-бета-карболин-3-карбоксил-тимопентин: наноконъюгат для высвобождения фармакофоров для лечения опухолей и осложнений. J Mater Chem B (2016) 4 (8): 1384–97. doi: 10.1039 / c5tb01930c
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Вэй XB, Wu RJ, Zhang LL, Ahmad B, Si DY, Zhang RJ. Экспрессия, очистка и характеристика нового гибридного пептида с сильной антибактериальной активностью. Молекулы (2018) 23 (6). doi: 10.3390 / modules23061491
CrossRef Полный текст | Google Scholar
27. Hong W, Zhang RH, Di ZY, He YW, Zhao ZH, Hu J и др. Разработка богатых гистидином пептидов с повышенной биодоступностью и ингибирующей активностью против вируса гепатита С. Биоматериалы (2013) 34 (13): 3511–22. doi: 10.1016 / j.biomaterials.2013.01.075
PubMed Реферат | CrossRef Полный текст | Google Scholar
28. Zeng ZY, Zhang RH, Hong W, Cheng YT, Wang HJ, Lang YG и др.Богатая гистидином модификация пептида, полученного из скорпиона, улучшает биодоступность и ингибирующую активность против HSV-1. Theranostics (2018) 8 (1): 199–211. doi: 10.7150 / thno.21425
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Папо Н., Орен З., Паг У., Сахл Х.Г., Шай Й. Последствия изменения последовательности амфипатического альфа-спирального антимикробного пептида и его диастереомеров. J Biol Chem (2002) 277 (37): 33913–21. DOI: 10.1074 / JBC.M204928200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Sun Y, Shang DJ. Подавляющее действие антимикробных пептидов на воспаление, вызванное липополисахаридами. Mediat Воспаление (2015). doi: 10.1155 / 2015/167572
CrossRef Полный текст | Google Scholar
32. Zhang XZ, Cui FC, Chen HQ, Zhang TS, Yang KC, Wang YB, et al. Анализ врожденного иммунного распознавания опиоидно-неактивных изомеров (+) — антагонистов Toll-подобного рецептора 4 (TLR4), производных налтрексона. J Chem Inf Model (2018) 58 (4): 816–25. doi: 10.1021 / acs.jcim.7b00717
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Деннисон С.Р., Харрис Ф., Бхатт Т., Сингх Дж., Феникс Д.А. Влияние С-концевого амидирования на эффективность и селективность противомикробных и противораковых пептидов. Mol Cell Biochem (2009) 332 (1-2): 43-50. doi: 10.1007 / s11010-009-0172-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Ким С., Ким С.С., Ли Б.Дж.Корреляция между активностями альфа-спиральных антимикробных пептидов и гидрофобностью, представленная временами удерживания при ОФ-ВЭЖХ. Пептиды (2005) 26 (11): 2050–6. doi: 10.1016 / j.peptides.2005.04.007
PubMed Реферат | CrossRef Полный текст | Google Scholar
35. Лю Чж, Чжан Дж.Дж., Хуанг XJ, Хуан Л.Н., Ли СТ, Ван З.П. Сульфат магния ингибирует секрецию высокоподвижного блока 1 группы из активированных липополисахаридом макрофагов RAW264.7 in vitro. J Surg Res (2013) 179 (1): E189–95.doi: 10.1016 / j.jss.2012.02.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Састри Г.М., Аджигирей М., Дэй Т., Аннабхимой Р., Шерман В. Подготовка белков и лигандов: параметры, протоколы и влияние на обогащение виртуального скрининга. J Comput Aid Mol Des (2013) 27 (3): 221–34. doi: 10.1007 / s10822-013-9644-8
CrossRef Полный текст | Google Scholar
37. Дуан Ю., Ву К., Чоудхури С., Ли М.К., Сюн Г.М., Чжан В. и др. Силовое поле с точечным зарядом для молекулярно-механического моделирования белков на основе квантово-механических расчетов в конденсированной фазе. Дж. Comput Chem (2003) 24 (16): 1999–2012. doi: 10.1002 / jcc.10349
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Wang JM, Wolf RM, Caldwell JW, Kollman PA, Case DA. Разработка и тестирование общего янтарного силового поля (том 25, стр. 1157, 2004 г.). J. Comput Chem (2005) 26 (1): 114–. doi: 10.1002 / jcc.20145
CrossRef Полный текст | Google Scholar
39. Йоргенсен В.Л., Чандрасекхар Дж., Мадура Д.Д., Импей Р.В., Кляйн М.Л. Сравнение простых потенциальных функций для моделирования жидкой воды. J Chem Phys (1983) 79: 926–35.
Google Scholar
40. Парринелло М.Р. А. Полиморфные переходы в монокристаллах: новый метод молекулярной динамики. J Appl Phys (1981) 52: 7182–90.
Google Scholar
41. Массова И., Коллман П.А. Комбинированный молекулярно-механический подход и подход с непрерывным растворителем (MM-PBSA / GBSA) для прогнозирования связывания лиганда. Perspect Drug Discovery (2000) 18: 113–35. doi: 10.1023 / A: 1008763014207
CrossRef Полный текст | Google Scholar
42.Дарден Т., Йорк Д. Педерсен Л. Сетка частиц Эвальда — метод N.Log (N) для сумм Эвальда в больших системах. J Chem Phys (1993) 98 (12): 10089–92. doi: 10.1063 / 1.464397
CrossRef Полный текст | Google Scholar
43. Адави Д., Касрави Ф. Б., Молин Г., Джеппссон Б. Влияние добавок Lactobacillus с аргинином и без него на повреждение печени и бактериальную транслокацию в модели острого повреждения печени у крыс. Гепатология (1997) 25 (3): 642–7. DOI: 10.1002 / hep.510250325
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Zhu X, Dong N, Wang ZY, Ma Z, Zhang LC, Ma QQ, et al. Дизайн несовершенно амфипатических альфа-спиральных антимикробных пептидов с повышенной селективностью клеток. Acta Biomater (2014) 10 (1): 244–57. doi: 10.1016 / j.actbio.2013.08.043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Гарате Дж. А., Остенбринк С. Липид А от распознавания липополисахаридов: структура, динамика и взаимодействие с помощью моделирования молекулярной динамики. Белки (2013) 81 (4): 658–74. doi: 10.1002 / prot.24223
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Zhang Y, Zhu JL, Guo L, Zou Y, Wang F, Shao H, et al. Холецистокинин защищает печень мыши от ишемии и реперфузионного повреждения. Int Immunopharmacol (2017) 48: 180–6. doi: 10.1016 / j.intimp.2017.03.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Исида В., Харада Ю., Фукуда К., Фукусима А. Ингибирование антимикробным пептидом LL37 индуцированных липополисахаридом врожденных иммунных ответов в фибробластах роговицы человека. Invest Ophth Vis Sci (2016) 57 (1): 30–9. doi: 10.1167 / iovs.15-17652
CrossRef Полный текст | Google Scholar
48. Романи Л., Ойкономоу В., Моретти С., Яннитти Р.Г., Д’Адамо М.К., Виллелла В.Р. и др. Тимозин альфа1 представляет собой потенциальное мощное средство для лечения муковисцидоза на основе одной молекулы. Nat Med (2017) 23 (5): 590–600. DOI: 10.1038 / nm.4305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. ДеГро Дж. И., Альмквист Р. Г., Хиберт К. К., Колвелл В. Т., Крэйз Дж., Хаяно Т. и др.Стабилизированные аналоги тимопентина 1. 4,5-кетометиленовые псевдопептиды. J Med Chem (1997) 40 (15): 2386–97. doi: 10.1021 / jm950803a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Лю Ю.Ф., Ся X, Сюй Л., Ван Ю.З. Разработка гибридных бета-шпилечных пептидов с повышенной клеточной специфичностью и сильной противовоспалительной активностью. Биоматериалы (2013) 34 (1): 237–50. doi: 10.1016 / j.biomaterials.2012.09.032
PubMed Реферат | CrossRef Полный текст | Google Scholar
51.Ма З., Вэй Д.Д., Ян П., Чжу Х, Шань А.С., Би З.П. Характеристика селективности клеток, физиологической стабильности и способности нейтрализации эндотоксинов пептидных амфифилов на основе альфа-спирали. Биоматериалы (2015) 52: 517–30. doi: 10.1016 / j.biomaterials.2015.02.063
PubMed Реферат | CrossRef Полный текст | Google Scholar
52. Zhang LL, Wei XB, Zhang RJ, Petitte J, Si DY, Li ZX, et al. Дизайн и разработка нового пептида для лечения воспаления кишечника. Front Immunol (2019) 10: 1841.doi: 10.3389 / fimmu.2019.01841
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Zhang LL, Wei XB, Zhang RJ, Si DY, Petitte JN, Ahmad B, et al. Новый пептид смягчает вызванное ЛПС воспаление кишечника и повреждение слизистой оболочки за счет своего антиоксидантного и антиэндотоксинового действия. Int J Mol Sci (2019) 20 (16). doi: 10.3390 / ijms20163974
CrossRef Полный текст | Google Scholar
54. Шимамура М., Накагами Х., Симидзу Х., Мукаи Х., Ватанабе Р., Окузоно Т. и др.Разработка нового пептида на основе RANKL, восстанавливающего микроглию пептида 1-AcN (MHP1-AcN), для лечения ишемического инсульта. Научный журнал (2018) 8 (1): 17770. doi: 10.1038 / s41598-018-35898-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. da Silva AVR, De Souza BM, Cabrera MPD, Dias NB, Gomes PC, Neto JR, et al. Влияние С-концевого амидирования мастопаранов на их биологическое действие и взаимодействие с мембранно-миметическими системами. Bba-биомембраны (2014) 1838 (10): 2357–68.doi: 10.1016 / j.bbamem.2014.06.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Гэн Y, Xing L, Sun MM, Su FC. Иммуномодулирующие эффекты сульфатированных полисахаридов пыльцы сосны на макрофаги мыши. Int J Biol Macromol (2016) 91: 846–55. doi: 10.1016 / j.ijbiomac.2016.06.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Li XQ, Xu W. TLR4-опосредованная активация макрофагов полисахаридной фракцией из Polyporus umbellatus (перс.) Фри. Дж. Этнофармакол (2011) 135 (1): 1–6. doi: 10.1016 / j.jep.2010.06.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Roh E, Lee HS, Kwak JA, Hong JT, Nam SY, Jung SH и др. MD-2 как мишень нелипидного халкона при ингибировании активности TLR4, индуцированной эндотоксином LPS. J Infect Dis (2011) 203 (7): 1012–20. doi: 10.1093 / infdis / jiq155
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Пак Б.С., Сонг Д.Х., Ким Х.М., Чой Б.С., Ли Х., Ли Джо.Структурная основа распознавания липополисахаридов комплексом TLR4-MD-2. Nature (2009) 458 (7242): 1191 – U130. doi: 10.1038 / nature07830
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Пери Ф., Пьяцца М. Терапевтическое воздействие на врожденный иммунитет с помощью антагонистов Toll-подобного рецептора 4 (TLR4). Biotechnol Adv (2012) 30 (1): 251–60. doi: 10.1016 / j.biotechadv.2011.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62.Zhang D, Cheng L, Huang X, Shi W., Xiang J, Gan H. Тетрандрин улучшает вызванный декстрансульфатом натрия колит у мышей за счет ингибирования активации ядерного фактора-каппа B. Int J Colorectal Dis (2009) 24 (1): 5–12. doi: 10.1007 / s00384-008-0544-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Bayraktar O, Tekin N, Aydin O, Akyuz F, Musmul A, Burukoglu D. Эффекты S-аллилцистеина на ткани легких и печени на крысиной модели индуцированного липополисахаридом сепсиса. N-S Arch Pharmacol (2015) 388 (3): 327–35. doi: 10.1007 / s00210-014-1076-z
CrossRef Полный текст | Google Scholar
66. Buell MG, Berin MC. Независимость от нейтрофилов начала травмы толстой кишки — Сравнение результатов трех моделей экспериментального колита у крысы. Digest Dis Sci (1994) 39 (12): 2575–88. doi: 10.1007 / Bf02087693
PubMed Аннотация | CrossRef Полный текст | Google Scholar
% PDF-1.4 % 984 0 объект > эндобдж xref 984 425 0000000016 00000 н. 0000012404 00000 п. 0000012470 00000 п. 0000024408 00000 п. 0000025224 00000 п. 0000025261 00000 п. 0000026004 00000 п. 0000026682 00000 п. 0000027360 00000 н. 0000028016 00000 п. 0000028181 00000 п. 0000028861 00000 п. 0000029026 00000 н. 0000029992 00000 н. 0000030858 00000 п. 0000031296 00000 п. 0000034004 00000 п. 0000035683 00000 п. 0000037339 00000 п. 0000039015 00000 п. 0000040709 00000 п. 0000042392 00000 п. 0000044082 00000 п. 0000045767 00000 п. 0000047467 00000 п. 0000049145 00000 п. 0000051234 00000 п. 0000053251 00000 п. 0000055522 00000 п. 0000058632 00000 п. 0000061188 00000 п. 0000064350 00000 п. 0000067211 00000 п. 0000069904 00000 п. 0000072745 00000 п. 0000075735 00000 п. 0000078395 00000 п. 0000081723 00000 п. 0000083908 00000 п. 0000085995 00000 п. 0000087797 00000 п. 0000089586 00000 п. 00000
00000 н. 0000194728 00000 н. 0000197431 00000 н. 0000200114 00000 н. 0000201932 00000 н. 0000203777 00000 н. 0000205581 00000 н. 0000207268 00000 н. 0000208939 00000 н. 0000210765 00000 н. 0000212553 00000 н. 0000214371 00000 н. 0000216108 00000 н. 0000217797 00000 н. 0000220199 00000 н. 0000223034 00000 н. 0000224865 00000 н. 0000226682 00000 н. 0000228393 00000 н. 0000230183 00000 п. 0000232026 00000 н. 0000233817 00000 н. 0000235641 00000 п. 0000237366 00000 н. 0000239077 00000 н. 0000240905 00000 н. 0000242724 00000 н. 0000244934 00000 н. 0000247946 00000 н. 0000250648 00000 н. 0000253511 00000 н. 0000256264 00000 н. 0000258919 00000 н. 0000261742 00000 н. 0000265085 00000 н. 0000267971 00000 н. 0000270709 00000 н. 0000273685 00000 н. 0000276486 00000 н. 0000279424 00000 н. 0000282235 00000 н. 0000284090 00000 н. 0000285951 00000 н. 0000287793 00000 н. 00002 00000 н. 0000293141 00000 п. 0000295959 00000 н. 0000299091 00000 н. 0000302176 00000 н. 0000304167 00000 н. 0000306238 00000 п. 0000308257 00000 н. 0000310151 00000 п. 0000312247 00000 н. 0000314092 00000 н. 0000316170 00000 н. 0000318026 00000 н. 0000320038 00000 н. 0000321890 00000 н. 0000323868 00000 н. 0000325860 00000 н. 0000327736 00000 н. 0000329616 00000 н. 0000331451 00000 н. 0000333324 00000 н. 0000335073 00000 н. 0000337408 00000 н. 0000339708 00000 н. 0000341926 00000 н. 0000343747 00000 н. 0000346120 00000 н. 0000347978 00000 п. 0000350321 00000 н. 0000352125 00000 н. 0000354502 00000 н. 0000356278 00000 н. 0000358897 00000 н. 0000360668 00000 н. 0000362658 00000 н. 0000364411 00000 н. 0000366158 00000 н. 0000367916 00000 н. 0000369547 00000 н. 0000371166 00000 н. 0000373099 00000 н. 0000374970 00000 н. 0000376768 00000 н. 0000378521 00000 н. 0000380309 00000 н. 0000382130 00000 н. 0000383756 00000 п. 0000385714 00000 н. 0000387362 00000 н. 0000389520 00000 н. 00003
00000 н.
0000393249 00000 н.
0000395040 00000 н.
0000397101 00000 п.
0000398858 00000 н.
0000400621 00000 н.
0000402390 00000 н.
0000404149 00000 н.
0000405895 00000 н.
0000407626 00000 н.
0000409865 00000 н.
0000411902 00000 н.
0000414125 00000 н.
0000416118 00000 н.
0000418332 00000 н.
0000420327 00000 н.
0000422454 00000 н.
0000424529 00000 н.
0000426646 00000 н.
0000428644 00000 н.
0000431331 00000 н.
0000433321 00000 п.
0000435812 00000 н.
0000437457 00000 п.
0000439383 00000 п.
0000441929 00000 н.
0000443572 00000 н.
0000445433 00000 н.
0000447773 00000 н.
0000449407 00000 н.
0000451451 00000 н.
0000453875 00000 п.
0000455517 00000 н.
0000457590 00000 н.
0000459284 00000 н.
0000460997 00000 н.
0000462723 00000 н.
0000464446 00000 н.
0000466148 00000 н.
0000467840 00000 н.
0000470344 00000 п.
0000472395 00000 н.
0000474978 00000 н.
0000477036 00000 н.
0000479462 00000 н.
0000481436 00000 н.
0000483965 00000 н.
0000486157 00000 н.
0000488474 00000 н.
00004 00000 н.
0000493404 00000 н.
0000495466 00000 н.
0000498015 00000 н.
0000499686 00000 н.
0000501871 00000 н.
0000504408 00000 н.
0000506072 00000 н.
0000508157 00000 н.
0000510700 00000 н.
0000512356 00000 н.
0000514401 00000 н.
0000516806 00000 н.
0000518450 00000 н.
0000520646 00000 н.
0000522295 00000 н.
0000523958 00000 н.
0000525623 00000 н.
0000527306 00000 н.
0000528998 00000 н.
0000530701 00000 н.
0000533177 00000 н.
0000535662 00000 н.
0000537891 00000 п.
0000540150 00000 н.
0000542406 00000 п.
0000544486 00000 н.
0000546554 00000 н.
0000548240 00000 н.
0000550414 00000 н.
0000552097 00000 н.
0000554046 00000 н.
0000555747 00000 н.
0000557617 00000 н.
0000559276 00000 н.
0000560942 00000 н.
0000562617 00000 н.
0000564286 00000 н.
0000565966 00000 н.
0000567659 00000 н.
0000569319 00000 п.
0000571174 00000 н.
0000573022 00000 н.
0000575078 00000 н.
0000576912 00000 н.
0000578843 00000 н.
0000580767 00000 н.
0000582717 00000 н.
0000584405 00000 н.
0000586323 00000 п.
0000588022 00000 н.
0000589924 00000 н.
00005 00000 н.
0000694356 00000 п.
0000696225 00000 н.
0000698081 00000 н.
0000699923 00000 п.
0000701744 00000 н.
0000703606 00000 н.
0000703904 00000 н.
0000704210 00000 п.
0000704542 00000 н.
0000704865 00000 н.
0000705191 00000 н.
0000705461 00000 п.
0000705751 00000 п.
0000706079 00000 п.
0000706351 00000 п.
0000706645 00000 н.
0000706972 00000 н.
0000707308 00000 н.
0000708970 00000 н.
0000709277 00000 н.
0000709604 00000 н.
0000711253 00000 н.
0000712912 00000 н.
0000714565 00000 н.
0000714898 00000 н.
0000716553 00000 н.
0000718205 00000 н.
0000718490 00000 н.
0000720149 00000 н.
0000721809 00000 н.
0000723444 00000 н.
0000725097 00000 н.
0000725440 00000 н.
0000727093 00000 н.
0000727428 00000 н.
0000727731 00000 н.
0000729385 00000 н.
0000729676 00000 н.
0000731338 00000 н.
0000732984 00000 н.
0000733311 00000 н.
0000734957 00000 н.
0000735300 00000 н.
0000736950 00000 н.
0000738578 00000 н.
0000740224 00000 н.
0000741878 00000 н.
0000743534 00000 н.
0000745205 00000 н.
0000746858 00000 н.
0000748506 00000 н.
0000748777 00000 н.
0000750437 00000 н.
0000752067 00000 н.
0000753712 00000 н.
0000755378 00000 н.
0000757033 00000 н.
0000758679 00000 н.
0000760321 00000 н.
0000760650 00000 н.
0000762314 00000 н.
0000764351 00000 п.
0000766319 00000 п. 00000 н.
00006

 Полис оригинальный, находится у владельца транспортного средства.
Полис оригинальный, находится у владельца транспортного средства.